
Les conditions de maintenance des coraux durs se sont améliorées depuis ces dernières années. Certains coraux, autrefois réputés difficiles, prospèrent aujourd'hui dans nos bacs. Les besoins élémentaires sont mieux compris et d’énormes progrès ont été réalisés au niveau de l’éclairage, de la nutrition, et surtout au niveau de la gestion de la qualité de l’eau, par l’ajout ou l’élimination de certains éléments. Nos "jardins marins" abritent des animaux, sur une période de temps relativement longue (au moins à nos yeux) et ces derniers croissent parfois très rapidement. Mais le succès de cette maintenance sur le long terme a conduit à l'apparition d'un nouveau problème : les parasites. Auparavant les coraux périssaient avant même que les parasites puissent s’installer. Aujourd'hui ces derniers trouvent dans les aquariums récifaux des conditions idéales pour se développer (surpopulation, coralliculture …). En quelques années d’aquariophilie seulement, nous avons dû lutter contre des organismes connus de tous, et parfois très gênants : anémones (Aiptasia, A. majano), planaires rouges, cyanobactéries, algues de toutes sortes… À chaque fois, des traitements relativement efficaces étaient disponibles et ont été appliqués avec succès. Mais cette fois-là, face aux deux parasites qui se sont succédés, aucune solution réelle n’était connue. Pourtant, aujourd'hui, nous pouvons dire que nous n’avons plus ces pestes. Dans cet article, nous décrirons la taxonomie de ces hôtes indésirables (classification biologique des organismes), leur identification et leur mode de vie. Puis, nous évoquerons les moyens de lutte trouvés (et pour certains testés) afin que d’autres aquariophiles puissent également les identifier et s’en défaire.
1. Historique
Acropora strudelwürmer ou Amakusaplana acroporae ?Observé en premier lieu dans des aquariums communautaires chez des particuliers la "planaire mangeuse d'Acropora" n'a pas été identifiée rapidemment par les scientifiques. Michael Mrutzeki a publié un rapport sur son expérience avec ce prédateur et lui a donné, le premier, le nom d''Acropora strudelwürmer signifiant littéralement : vers mangeur d'Acropora. C'est seulement en 2011, que les scientifiques ont identifié ce prédateur en le nommant Amakusaplana acroporae. Afin de prendre en compte cette évolution cette note écrite en 2006 a été actualisée avec le vrai nom du prédateur.
Notre épopée aquariophilie commence en mars 2001, et avec l’aide et les conseils de nombreux aquariophiles les premiers coraux durs arrivent en décembre 2001. Malgré des périodes de creux, le bac s’étoffe et les animaux se développent. L’ajout d’un autre aquarium dédié nous permet de développer de plus en plus les SPS. La croissance et la coloration sont au rendez-vous jusqu’en 2002. Suite à l’introduction d’un Porites sp., des petites limaces blanchâtres apparaissent. Après plusieurs semaines, alors que l’on enlevait consciencieusement ces organismes sur le Porites sp., nos Montipora sp. plateaux se sont mis à présenter des blanchiments, qui allaient vite devenir caractéristiques. Une première espèce était touchée (les plateaux verts), puis une deuxième (les plateaux rouges), enfin quelques semaines plus tard, c'était au tour des Montipora sp. digités. Tous nos Montipora sp.étaient atteints du même mal, et donc à priori du même parasite. En avril 2004 après 6 mois de recherches intensives, l’identité du parasite est établie : Phestilla minor. Nous nous en sommes finalement débarrassé en août 2004. Ce parasite appartenait à l’embranchement des Mollusques. Comme un problème n’arrive jamais seul en aquariophilie récifale, un autre parasite a infecté notre bac en septembre 2003, toujours consécutivement à l’introduction d’un nouveau corail. Ce dernier s’attaquait aux Acropora sp. Son identification fût plus aisée, grâce aux informations fournies par des sites allemands. Il s'agissait d'Acropora strudelwürmer, aujourd'hui renommé Amakusaplana acroporae (voir le commentaire), un terme correspondant à Acropora Eating Flat Worm (AEFW) des sites anglophones (nous n’avons pas trouvé son nom latin). Ce parasite appartient à l’embranchement des Plathelminthes. Son éradication fût très difficile.
Identifier ce type de parasites n’est pas facile, mais cette étape est à mon sens indispensable. Il est en effet difficile de lutter contre un parasite quand on ne l’a pas identifié le plus précisément possible. Afin de pouvoir nommer ces organismes, nous avons cherché sur Internet des aquariophiles susceptibles d’avoir eu les mêmes attaques. La planaire Amakusaplana acroporae, malgré son caractère mimétique fût identifiée relativement facilement, grâce notamment à l'article de Régis Doutres et à ses liens vers des sites allemands. L’identification de l’autre parasite Phestilla minor (P. lugubris ?) a été rendue plus délicate par le manque de documentation. Toutefois, après de nombreuses recherches, et l'aide apportée par l’intermédiaire des deux sites, Nembro et Sea Slug Forum (voir les liens en bas de page), nous avons pu identifier ce nudibranche. Mais même si les ressemblances morphologiques et comportementales semblent indiquer qu'il s'agit bien de Phestilla minor l’identification de ce parasite n’est pas totalement sûre.
2. Description générale
Ces deux parasites appartiennent à deux embranchements différents : les Plathelminthes, pour Amakusaplana acroporae, et les Mollusques pour Phestilla minor.
2.1. Les nudibranches
Les nudibranches appartiennent à l’embranchement des Mollusques, à la classe des Gastéropodes, et à la sous-classe des Opistobranches. Les Opistobranches sont des limaces de mer, toutes exclusivement marines. La plupart des Opistobranches sont des carnivores hautement spécialisés qui se nourrissent de proies sous formes libres (escargots, bivalves, vers, crustacés, autres Opistobranches), ou sous formes fixées (bryozoaires, hydroïdes, coraux, ascidies, éponges…). Mais certaines consomment également des d’algues (Elysia spp.) ou des oeufs de poissons. La classe des Opisthobranche est divisée en sept ordres. L’ordre des Nudibranches, tous carnivores, est composé de quatre sous-ordres : les Dendronotacés, les Doridacés, les Arminacés et les Aeolidacés. Les nudibranches sont caractérisés par leurs branchies plumeuses nues.
| Sous classe | Ordre | Sous-ordre | Exemple Genre / espèce |
Régime alimentaire |
|---|---|---|---|---|
| Opistobranchia | Gymnosomata | |||
| Thecosomata | ||||
| Cephalapsidea | Chelinodura varians (prédateur de planaires) | Prédateurs de vers, bivalves, échinodermes... | ||
| Notaspidea | ||||
| Anaspidea | Aplysia parvula, Dolabella auricularia | Herbivores. | ||
| Sacoglossa | Elysia sp., Tridachia sp. | Herbivores. | ||
| Nudibranchia | Dendronotacea | Prédateurs. | ||
| Doridacea | Nembrotha kubaryana | Prédateurs de tuniciers, opistobranches... | ||
| Eolidacea | Cuthona sp., Phestilla melanobranchia | Prédateurs. | ||
| Arminacea | Prédateurs. |
Les prédateurs de coraux durs (Scleractinia) appartiendraient tous au sous-ordre des Eolidacea et à trois genres : Cuthona, Phestilla et Pinufius.
2.1.1. Morphologie
Les nudibranches peuvent mesurer de quelques centimètres à plus d'une quinzaine. Ces animaux ne sont pas protégés par une coquille et présentent des branchies plumeuses apparentes (d’où le nom de nudibranches). La coquille est remplacée par des spicules calcaires, présentes dans l’épiderme. Cet organisme porte des tentacules sur le dos, les papilles dorsales, utilisées pour la respiration. Il dispose également de deux paires de tentacules sur la tête dont l’une, le rhinophore, permet de détecter les bruits et les odeurs. Les nudibranches disposent d’un ruban de « dents » appelé radula adapté spécifiquement à leur proie.
2.1.2. Mode de vie
Les nudibranches sont des organismes benthiques, c'est-à-dire qu’ils vivent sur un substrat. En principe, leur distribution suit la disponibilité de la nourriture. La durée de vie d’un nudibranche peut atteindre un an. Toutefois, certains nudibranches peuvent s’alimenter sur une espèce transitoire et leur durée de vie ne sera alors que de quelques semaines. Cet animal est un hermaphrodite simultané avec fécondation croisée (besoin d’un autre partenaire). Il possède des organes mâles et femelles en même temps, ce qui augmente ses chances de s’accoupler. Les œufs sont pondus à proximité, voire sur la proie, dont le nudibranche s’alimente. Le développement des œufs prend entre 5 et 50 jours, et dépend des conditions environnementales. Les oeufs se développent en une forme larvaire, appelée larve véligère, qui dérive sous forme de plancton, ce qui concours à la dispersion de l'espèce. Il est fondamental, lorsque l'on souhaite se débarrasser de ce parasite, de se souvenir de ces trois phases de la vie de l'animal. En général, le diamètre des œufs est caractéristique de l'espèce et fournit des informations sur le type de développement de la larve. Plus le diamètre de l’oeuf est important, et plus le développement de l'animal se fera au sein de l’œuf, au détriment du stade planctonique (natation libre). Tom Thompson a proposé une classification des larves en fonction de la taille des œufs :
- pour des œufs de taille entre 40 et 170 μm, la larve serait planctotrophique (natation libre et alimentation dans le plancton : temps long),
- pour des œufs entre 110 et 250 μm, la larve serait lecithotrophic (natation libre sans alimentation dans le plancton : temps court),
- pour une taille d’œuf de 205 à 400 μm, la larve aurait un développement direct (pas de passage par la phase libre).
Tous les Opisthobranches sont des prédateurs qui se nourrissent d’autres invertébrés (éponges, hydraires, anémones, coraux, nudibranches). Chaque espèce a une source spécifique de nourriture (proie) dont elle réutilise, le cas échéant, les composés toxiques. Certains stockent par exemple les cellules urticantes (nématocystes) de leur proie dans leur corps et utilisent ce poison pour se défendre. Du coup, ces organismes ont peu de prédateurs naturels, les colorations étonnantes dont ils sont en général affublés, rappelant à tous, le danger qu'il y aurait à s'y attaquer (les couleurs vives sont généralement une indication de la nature toxique des animaux).
2.1.3. Exemples connus en aquariophilie
Certains Opistobranches sont utilisés pour endiguer la prolifération de parasites : Chelinodura varians est utilisé pour lutter contre les planaires et notamment Convolutriloba retrogemma. D’autres Opistobranches appartenant à des ordres différents permettent de limiter la prolifération des algues en aquariophilie : Elysia viridis, Tridachia crispata, Aplysia parvula, Dolabella auricularia … Au niveau des Nudibranches, l’exemple le plus connu est probablement Berghia verrucicornis utilisé parfois pour lutter contre les anémones de verre Aiptasia. Cet organisme a toutes les caractéristiques des nudibranches : prédation spécifique sur l’Aiptasia, un cnidaire urticant dont il détourne les composés toxiques à son profit. Sur les Montipora de notre bac, nous pensons qu'il s'agit de Phestilla minor (famille Aeolidiidae sous-ordre Aeolidina) bien que son identification ne soit pas certaine.


2.2. Les plathelminthes
2.2.1. Systématique
L’embranchement des Plathelminthes renferme un grand nombre d’espèces (25 000) dont une majorité de parasites d’animaux. On distingue trois classes : les Trématodes, les Cestodes et les Turbellariés. La classe des Turbellariés ou "vers plats" est une classe primitive. Ses représentants sont plus connus sous le nom de "planaires". Les organismes de cette classe sont tous aquatiques et possèdent un épiderme cilié qui sert entre autres à la locomotion. La plus grande diversité de planaires se situe au niveau des barrières coralliennes tropicales. Dans le milieu marin, on trouve parfois des formes non parasites. Contrairement aux vers parasitaires, ces espèces disposent de systèmes digestif, excréteur, nerveux et musculaire très développés. Les plathelminthes se différencient visuellement des nudibranches par l'absence de branchies extérieures et par la très faible épaisseur de leur corps.
| Classe | Ordre | Sous-ordre | Famille | Genre |
|---|---|---|---|---|
| Turbellaria | Acoela | Convolutidae | Convolutriloba, Waminoa | |
| Otocelididae | Notocelis | |||
| Polyclada | Acotylea | Callioplanidae | ||
| Emprostopharynx | ||||
| Euplanidae | ||||
| Leptoplanidae | ||||
| Planoceridae | ||||
| Prosthiostomidae | Prosthiostomum montiporae | |||
| Stylochoplanidae | ||||
| Stylochidae | ||||
| Cotylea | Pericelidae | |||
| Pseudocerotidae | ||||
| Prolecithophora | Combinata | Cylindrostomidae | ||
| Separala | Plagiostomidae | |||
| Proseriata | Separala | Monocelididae | ||
| Rhabdocoela | Kalyptorhyncha | Koinocystididae | ||
| Polycystidae | ||||
| Schizorhynchidae | ||||
| Typhloplanoida | Trigonostomidae | |||
| Tricladida | Bdellouridae | |||
| Bipalidae | ||||
| Geoplanidae | ||||
| Planariidae | ||||
| Rhyncodemidae |
Il existe de nombreuses planaires qui parasitent les coraux. Certaines sont présentes sur des coraux mous (Discosoma), d’autres sur des coraux durs Plerogyra sinuosa ou Heliofungia actiniformis (Waminoa sp.). Amakusaplana acroporae ressemble fortement à Notoplana tremellaris de la famille des Leptoplanidae. (Saltcorner).
2.2.2. Morphologie
Les plathelminthes sont des animaux à symétrie bilatérale, vermiformes, allongés et mous. Ils ne possèdent pas de cavité générale interne (le cœlome) et sont donc dits "acœlomates". Leur taille varie suivant l’espèce de quelques mm à plusieurs cm. Ils sont généralement aplatis dorso-ventralement, et leur épaisseur ne dépasse pas un ou deux millimètres. Les organes des sens sont primitifs, ce qui se traduit par la présence de simples tâches oculaires et parfois à celle de tentacules olfactifs. La bouche se situe à l'extrémité d'un tube pharyngien, rétracté en position de repos, et évaginable au moment de la nutrition. Les plathelminthes possèdent un tube digestif archaïque peu développé. Les planaires se nourrissent d’invertébrés qu’elles capturent à l’aide de cils disposés le long de leur corps et sécrétent un mucus digestif. Les nutriments passent directement de cellules en cellules (phagocytose). Les déchets non digérés sont expulsés par la bouche. Il n’existe pas d’appareil respiratoire différencié mais l’aplatissement du corps permet une bonne diffusion de l’oxygène dans l’organisme. La face inférieure dispose de cils permettant le déplacement. Le mucus présent sur ces soies permet à l'animal de se défendre contre d’éventuels prédateurs. Des composants de cette substance pourraient provenir, dans certains cas, du recyclage des cnidocystes de leurs proies, qu'ils seraient ainsi capables de réutiliser pour leur propre défense.
2.2.3. Mode de vie
La très grande majorité des plathelminthes sont des hermaphrodites synchrones, c’est à dire que le même individu possède simultanément des organes reproducteurs mâle et femelle. Cela leur permet d’augmenter leur taux de reproduction puisque chaque rencontre entre deux individus se traduira par une fécondation croisée de l’un et de l’autre. La reproduction se fait tête-bêche. Certains plathelminthes peuvent même parfois s’autoféconder. Leur ponte qui peut compter de quelques dizaines à plusieurs milliers d’œufs prend la forme d’un ruban spiralé, d’un tortillon ou d’un amas. L'éclosion a lieu de quelques heures à plusieurs jours après la fécondation. La larve est planctonique et va évoluer vers un mode de vie benthique. Suivant les conditions du milieu, les œufs vont donner naissance à des jeunes larves. Les œufs ont également la capacité de s’enkyster en fonction des paramètres environnementaux (forme de résistance). Les planaires ont une grande faculté de régénération, un animal coupé en deux peut former deux individus. C’est généralement une agression extérieure qui produit ce phénomène.
2.2.4. Exemples connus en aquariophilie
Les plus connus des plathelminthes sont les planaires rouges : Convolutriloba retrogemma. Cette espèce, présente dans tout l’Indo–Pacifique, consomme dans nos bacs les produits du métabolisme des algues symbiotiques et prolifère en fonction de l’éclairage, de la charge en nutriments dissous et de l’oxygénation de l’eau. D’autres planaires appartenant à l’ordre des Polycladidés sont prédatrices de coraux mous (Sarcophyton, Sinularia) ou des corallimorphaires (Discosoma, Ricordea …). La planaire Amakusaplana acroporae est spécifique du genre Acropora.
3. Descriptif particulier de deux parasites trouvés dans notre bac
3.1. Source de la contamination
Malgré les précautions prises, les parasites ont été introduits à la suite de l’achat de coraux qui à première vue paraissaient sains. Et pourtant, avant toute introduction nous essayons systématiquement de voir si le corail ne présente rien d’anormal. Mais ne connaissant ni les symptômes ni l'aspect des parasites, nous n’avons rien détecté. Les premiers symptômes peuvent survenir, suivant les conditions environnementales, après une période de latence plus ou moins longue, rendant d'autant plus délicate l’identification de la source. Malgré tout, trouver le porteur rapidement est important car cela facilite l'identification du parasite (en fonction du corail concerné), et dans le cas de bouturage, permet de remonter au détenteur de la source de la contamination et donc de stopper sa propagation.
3.2. Symptômes
3.2.1. Le nudibranche Phestilla minor

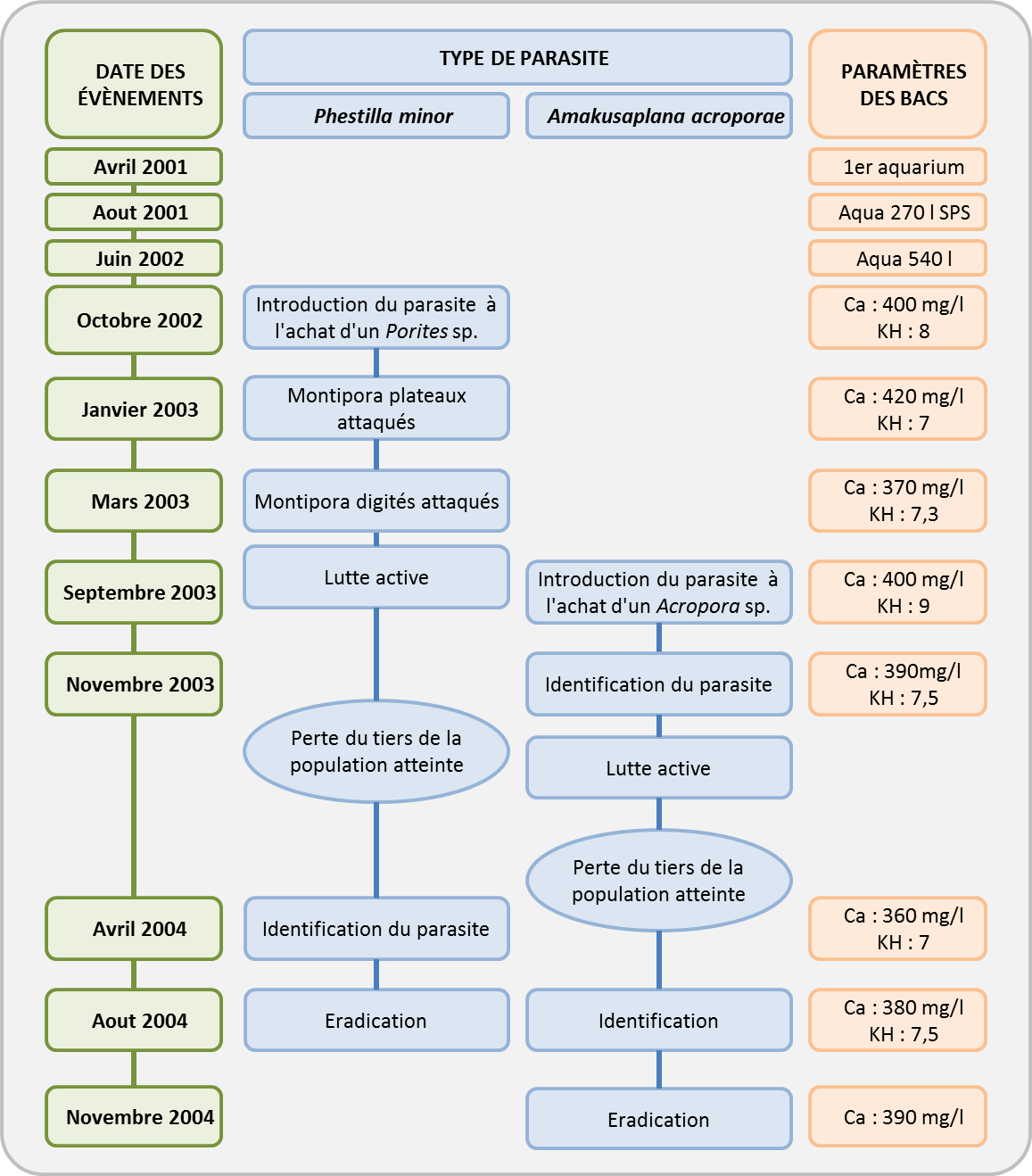
La première observation de P. minor a été réalisée sur le Porites, source de la contamination. Les nudibranches étaient présents sur le corail, sans qu’il y ait de dégâts apparents. Mais quelques semaines plus tard, des nécroses sont apparues à la base, sur le pourtour, et surtout sur les zones de jointures entre des lamelles des Montipora plateaux.

Ces organismes étaient de couleur blanchâtre et se développaient rapidement sans pour autant que l'accroissement de leur population soit particulièrement visible. Ces nudibranches restent en effet cachés durant la journée sous ou dans les anfractuosités du corail et sortent la nuit pour notamment consommer le corail sur lequel ils se sont installés.
Lorsque l’infestation est très importante, les nudibranches sont visibles sur le pourtour du corail, sous le plateau, et localisés plutôt sur les parties vivantes de leur hôte. Très petits dans un premier temps (3 à 5 mm), ils ont fini par atteindre environ 1 cm. Malgré nos interventions répétées (lutte mécanique à la brosse à dent), la population a continué d'augmenter sensiblement. D'autre part, la présence des premiers œufs disposés en amas blancs sur le corail montraient que le parasite avait trouvé des conditions lui permettant de boucler son cycle de développement et d'envahir un premier groupe de corail.

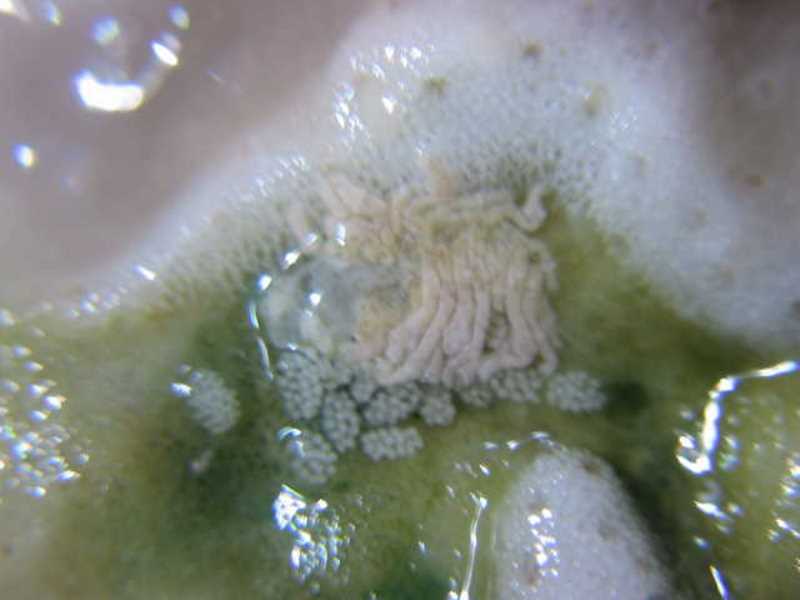
Par la suite, ce fût au tour des Montipora plateaux rouges de présenter ces symptômes de nécrose en périphérie. Les mêmes parasites furent trouvés sur ces coraux. Enfin, quelques semaines plus tard, les Montipora digités (digité rouge, vert et gris-bleuté) étaient eux aussi atteints. Bref, en trois/quatre mois, la population s’était développée de façon exponentielle et parasitait toutes nos souches de Porites et de Montipora.
3.2.2. La planaire Amakusaplana acroporae
Alors que nous complétions les brossages très réguliers des coraux (deux fois par semaine) par des traitements au lugol (sur le corail et en dehors du bac), un autre problème survint (pour ne citer que ceux qui nous intéressent dans cet article). Un premier Acropora, puis progressivement la majorité d'entre eux, perdirent leur coloration, devenant marrons et ternes. Premiers suspects, les paramètres du bac, pourtant corrects, sans être exceptionnels. La lumière a donc été changée, et nous avons effectué des changements d’eau plus importants que d'habitude, mais rien n’y a fait. Sans que l’on puisse savoir pourquoi, nos Acropora perdaient leur couleur et commençaient à nécroser à la base. Détail caractéristique, mais que nous ne l'avons compris que plus tard, les tissus devenus marrons présentaient des tâches de dépigmentation, ressemblant à des traces de piqûres.

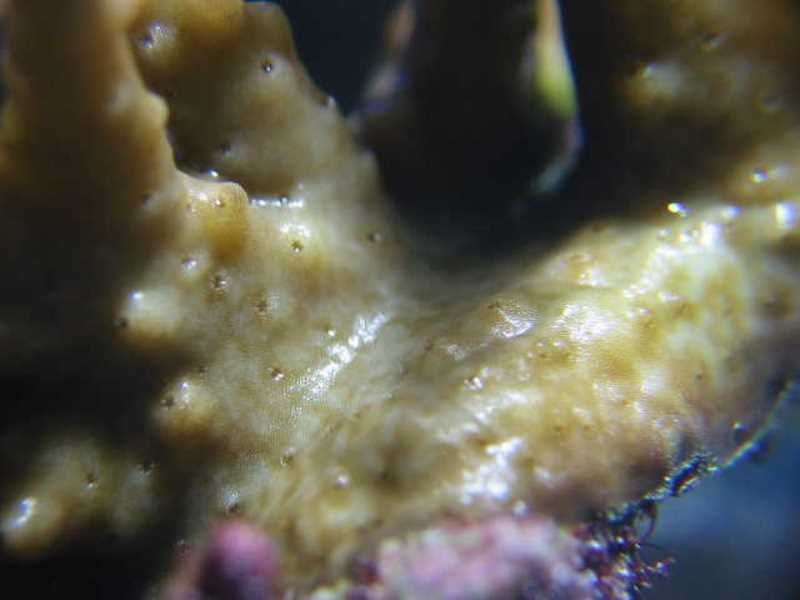
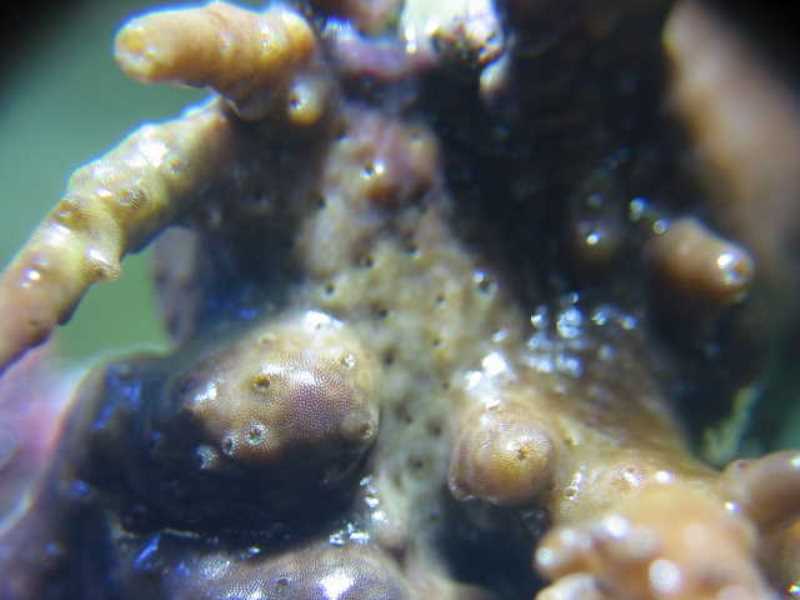

Après des recherches sur internet, nous sommes tombés sur l’article de Régis Doutres qui présentait Amakusaplana acroporae et les symptômes de ses attaques : une coloration brune généralisée avec une dépigmentation sur les faces inférieures du corail. Après un examen visuel approfondi de nos Acropora, nous avons pu constater que des piqûres de succion étaient effectivement présentes mais aucun animal parasite n’a pu être détecté. C’est seulement en sortant l’Acropora ou en le mettant dans le flux puissant d’une pompe que les planaires devinrent visibles et se décollaient.
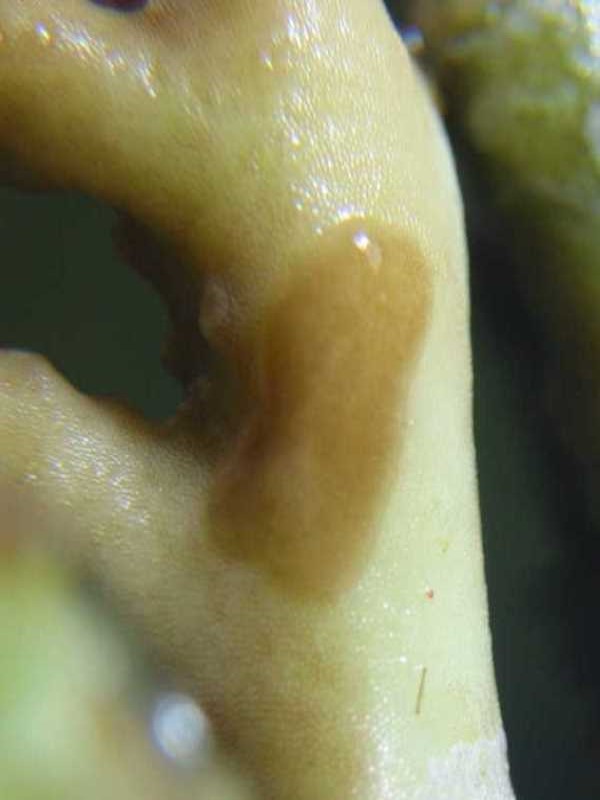


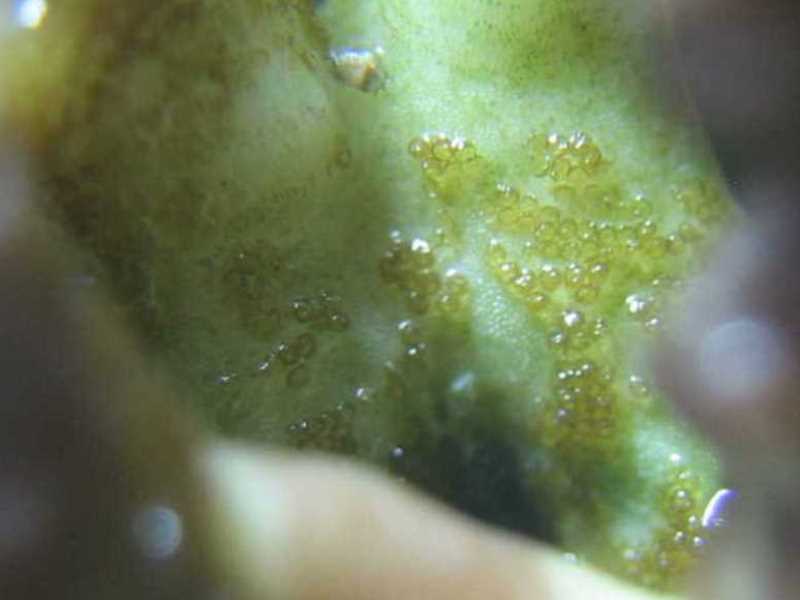
Le coupable était repéré ! Mais son mimétisme avec son hôte est tel que seuls les symptômes de dépigmentation sont réellement visibles. Les premiers œufs, brunâtres, assez petits (1 à 2 mm), plutôt ronds et en amas, ont été localisés sur les zones de nécrose à la base des hôtes infestés.
Ce parasite avait réalisé son cycle complet lui aussi. Le corail source a été identifié. Il est mort par la suite malgré les essais de traitements. Son origine géographique n’a pas pu être identifiée. Nous nous trouvions devant une nouvelle impasse face à un nouvel envahisseur pour lequel, là encore, les informations étaient pratiquement inexistantes…
3.3. Stratégies utilisées par ces parasites
Ces deux groupes de parasites disposent de stratégies différentes. Dans la plupart des cas, les nudibranches arborent des couleurs éclatantes, prévenant ainsi d’éventuels prédateurs de leur toxicité. D’autres sont au contraire colorés subtilement et se confondent avec leurs proies. On parle alors de mimétisme homochromique qui consiste, chez certaines espèces, à prendre la même couleur que leur environnement.
Autre curiosité, ces animaux se nourrissent de coraux qui disposent pourtant de moyens de protection efficaces : les nématocystes. Mais les nudibranches excrètent un mucus qui insensibilise leurs cellules sensorielles des attaques des nématocystes et empêche la transmission de l’influx nerveux. Les cellules urticantes n’éclatent pas, elles sont intégrées directement dans l’animal. Elles sont en fait avalées sans être digérées puis envoyées dans les papilles dorsales où elles feront partie intégrante du mécanisme de défense du parasite. L’animal dispose donc d’un moyen de défense efficace en plus de sa capacité à se dissimuler dans les recoins et les anfractuosités du corail.
Les nudibranches présents sur les Montipora vivent sur le dessous de la colonie ou dans des anfractuosités du corail. Ils sont de la couleur de la face non exposée du corail, plutôt blanc crème. Le nématocyste du Montipora est relativement peu efficace pour sa propre défense et donc pour celle du parasite. Ce dernier adopte donc une stratégie de camouflage. Les plathelminthes disposent de la même capacité à ingérer et recycler les défenses de leurs proies mais ils sont également capables d'intégrer et d'utiliser les pigments de leurs hôtes, facilitant ainsi leur mimétisme.
A la fois invisible et toxique, ce parasite dispose donc d’un arsenal défensif très efficace pour lutter contre des prédateurs éventuels. Nudibranches et plathelminthes, même s'ils appartiennent à deux embranchements différents, ont donc à leur disposition les mêmes stratégies d'attaque et de défense.
3.4. Une remarquable adaptation
Ces deux organismes se sont adaptés rapidement aux nouvelles conditions du milieu qu'ils ont trouvé dans notre bac. Le nudibranche Phestilla minor a eu une période d’adaptation plus lente, du fait probablement de son passage du Porites au Montipora. On peut à ce propos, s'interroger sur l'exactitude de l'identification que nous avons faite à la fois du parasite et de sa source. Il existe très certainement de nombreuses espèces encore indéterminées de ce type de parasite. Les nudibranches peuvent s’alimenter sur une espèce transitoire mais leur durée de vie est alors plus courte (quelques semaines). Nous avons pu constater qu'au fil du temps, le cycle biologique de ces animaux se raccourcissait. Dans de bonnes conditions (dans notre bac !) Phestilla minor arrivait à boucler son cycle de développement entre 12 et 15 jours, contre une semaine environ pour Amakusaplana acroporae (d’après les pontes). Les conditions environnementales jouent un rôle primordial sur le développement de ces animaux. C'est notamment le cas de la température qui en diminuant ralentit le métabolisme et le cycle de vie de ces organismes. Nous ne connaissons pas exactement les plages de valeurs des facteurs qui pourraient influencer négativement leur développement (T°, pH, lumière…) mais elles doivent certainement être incompatibles avec la maintenance des hôtes que nous abritons. On peut se demander également pourquoi des parasites se développent aussi rapidement, et connaissent de telles explosions démographiques dans nos bacs. Plusieurs réponses à cela :
- La première cause, la plus importante, c’est évidemment l’absence d’un prédateur, d'un hyper parasite, qui pourrait limiter leur développement. Ils sont libres de se développer et seule l’absence de nourriture (du corail hôte donc) mettra un frein à leur prolifération.
- L’association de coraux de provenances différentes dans un bac augmente la chance d’avoir un parasite. Des coraux présents dans une autre zone géographique où le parasite est inconnu ont plus de risque de se faire attaquer (pas de phénomène de résistance). Le corail n’a pas le temps sur une échelle de temps courte de s’adapter pour lutter contre ce prédateur.
- Enfin, les conditions particulières que l'on s'efforce de maintenir dans nos bac peuvent favoriser les parasites. Croissances exceptionnelles des coraux (maintenus dans des conditions optimales), absence d’événements climatiques dévastateur, forte concurrence pour l’espace entre les animaux (stress), accumulation de certaines substances (tanins...), agressions entre coraux, paramètres instables (pH…) sont autant de facteurs qui pourraient jouer un rôle dans les relations parasite/corail.
3.5. Spécificité alimentaire
Pour gagner en efficacité, la morphologie de ces animaux s'est adaptée aux types de proies qu'ils consomment. L'évolution de la radula est à ce titre significative. Large, comportant de nombreuses dents, avec une grande surface d'attaque, elle permet aux nudibranches appartenant au sous-ordre des Doridacea d'être particulièrement bien adaptée à la prédation des éponges. Les nudibranches du sous-ordre des Aolidacea ont, à l’inverse, des radulas étroites qui leur permettent de s’alimenter au mieux sur certains hydraires (Seaslugforum, B.Rudmann). De même, d'autres nudibranches ne mangent spécifiquement que des polypes de certains coraux. Les dents de la radula de ces espèces corallivores sont en général fines et longues et leur offrent la possibilité de racler efficacement la fine couche de tissus vivants recouvrant le squelette corallien. Il est d'ailleurs théoriquement possible d'utiliser les spécificités alimentaires des nudibranches pour lutter contre certains indésirables : les Berghia contre les Aiptasia et Chelinodura varians contre les planaires rouges. Mais que se passe-t-il quand leurs proies disparaissent ? La spécificité de ces organismes envers leurs proies, gage d'efficacité, constitue également une faiblesse. Les prédateurs dans le milieu naturel régulent leur population et peuvent se disperser, à la recherche de nouvelles proies. Mais dans un bac, la disparition de leur unique source d'alimentation conduit inévitablement à leur disparition. Il en est de même pour les planaires Amakusaplana acroporae qui sont spécifiques d'un hôte donné. Dans un système fermé, ces parasites ne peuvent pas évoluer sur une échelle de temps aussi courte afin de parasiter un autre type de proie. Cette spécificité alimentaire nous fournit donc un moyen de lutte évident contre ces animaux : l’absence de proie entraînera la mort du parasite ou son maintien sous une forme de vie ralentie.
4. Différents moyens de lutte
Afin de pouvoir lutter efficacement, il faut connaître son ennemi. L’identification taxonomique est donc primordiale. La méthode de lutte devra être choisie en fonction des caractéristiques du bac. En effet, de nombreux paramètres vont rentrer en jeu tels que : le type de maintenance, le nombre d’animaux potentiellement atteints, la population en poissons…
Une fois le parasite identifié, il faut agir rapidement. Plus on agit vite et plus on a de facilité à l'éliminer. Cela vaut bien sûr pour tous les parasites. Nous décrivons ici plusieurs moyens de lutte afin que l’aquariophile puisse choisir le plus approprié à ses propres conditions. Il ne faut surtout pas oublier que chaque bac répond différemment à un traitement, quel qu’il soit. Tout aquarium doit être considéré comme un écosystème unique car il dépend de contraintes abiotiques et biotiques (consommateurs, pollueurs) différentes. Ce qui a réussi à l’un, ne réussira pas obligatoirement à l’autre.
La première chose à faire est d’enlever les hôtes contaminés et de les mettre à part afin de ne conserver dans le bac principal que les coraux sains. Si l’action est très rapide, avant la dissémination du parasite, on peut espérer, sans autre intervention, sauvegarder les autres coraux de la même espèce. Puisque comme nous l'avons vu, l’un des points faibles de ces parasites réside dans sa dépendance à un hôte spécifique. Privé de celui-ci, la forme parasite sera détruite.
La question qui se pose ensuite est dans combien de temps pourrais-je remettre un corail du même type que celui-ci ? Un mois, 6 mois, 1 an, jamais... Autrement dit, existe-t-il des formes d’enkystement, de vie ralentie pour ces parasites obligatoires ? Les Nématodes (autre embranchement : vers ronds) possèdent cette capacité, et peuvent attaquer des hôtes après être restés cachés plusieurs années sous une forme résistante.
Nous ne connaissons pas la réponse exacte pour les plathelminthes et les nudibranches, mais il semble qu'une période courte d’un à deux mois sans Montipora (absence totale) dans un bac permettrait de se débarrasser du nudibranche Phestilla. C’est bien évidemment la façon la plus facile de lutter efficacement contre ces indésirables, mais qui suppose la perte des souches de corail contaminées.
Concernant les planaires, aucun test de ce type n’a été réalisé. Que faire des souches infestées : Pour Phestilla, un article sur le net évoquait la possibilité d'utiliser le "bullage" des nudibranches sur un Porites. Selon cette méthode, il suffirait de mettre le corail dans un rideau de bulle pour décoller les nudibranches. Dans notre cas, cela n’a pas fonctionné. Même le flux direct d'une pompe ne suffisait pas toujours à les décrocher du corail. De plus, les œufs restant en place, il faudra dans tous les cas des moyens de lutte complémentaires. A cette fin, on peut envisage de casser le cycle de développement par l’utilisation d’un filtre UV. Ce dernier devrait être efficace sur le stade larvaire (larve planctonique). Il suffirait donc en complément d’éliminer les adultes présents sur les coraux. Cela suppose toutefois que le développement larvaire ne soit pas direct mais planctotrophique ou lecithotrophique (natation libre). Le stade larvaire pouvant être extrêmement court (1 à 2 heures) il serait judicieux de placer l’UV directement dans le bac plutôt que dans la décantation, de manière à éliminer le maximum de larves dans un minimum de temps. Dans tous les cas, en absence de phase libre (sans phase planctonique), ce traitement sera inefficace. Nous n'avons pas utilisé cette technique, mais il pourrait être intéressant de tester son efficacité (merci de nous faire part de vos expériences au travers des forums de Cap récifal).
4.1. Lutte biologique
Par lutte biologique, nous entendons ici l’utilisation d’un prédateur du parasite dont nous souhaitons nous débarrasser. C’est la méthode vers laquelle nous nous sommes dirigés en premier car elle n’a normalement que peu d’effets indésirables. Certaines contraintes existent quand même, puisqu'on ne connaît pas toujours le comportement de cet auxiliaire après la disparition du parasite (possibilité de se retourner sur d'autres organismes du bac …). S’orienter vers un auxiliaire naturel demande donc une bonne connaissance du parasite, mais aussi de son prédateur.
4.1.1. Les poissons
Dans notre cas, la présence de certains poissons dans le bac tels que : Synchiropus splendidus, Koumansetta rainfordi, Pseudochromis fridmani, Chelmon rostratus réputés pour leur rôle de prédation de la micro faune n’a pas permis d’endiguer la prolifération des deux parasites.
Soulignons que notre femelle S. splendidus, lors d'une autre infestation, avait joué un rôle important dans la prédation de planaires rouges Convolutriloba retrogema. Mais dans le cas présent elle ne s’est pas du tout intéressée aux planaires d' Acropora.
D’autres poissons se nourrissent de certains planaires. Ils n'ont toutefois pas été utilisés pour cause notamment d'incompatibilité avec la population déjà présente dans le bac (agression inter-spécifique entre labre et mandarin). On peut citer entre autres Pseudocheilinus hexataenia, Synchiropus picturatus, Halichoeres marginatus, H. viridis, Thalassoma lunare, et T. hardwicke. Testé chez un ami, le labre rayé Pseudocheilinus hexataenia, pourtant réputé grand prédateur de planaires, ne semble pas s'être attaqué aux planaires d'Acropora (ou en tout cas, pas suffisamment pour que cela soit visible). Certains labres du genre Anampses pourraient avoir une certaine efficacité, mais sans aucune certitude. Thalassoma hardwicke a été testé par Michael Mrutzek où, dans des conditions particulières, certains individus, auraient fait preuve d'une relative efficacité. Ce poisson mesurant plus de 20 cm à l’état adulte il n'est donc pas adapté à tous les bacs. Enfin, Halichoeres melanurus et H. leucurus ont été testés avec grand succès contre les planaires "classiques" et pourraient également être efficaces pour éradiquer les planaires d'Acropora (J. Charles Delbeek, Communication Personnelle).
4.1.2. Les crustacés
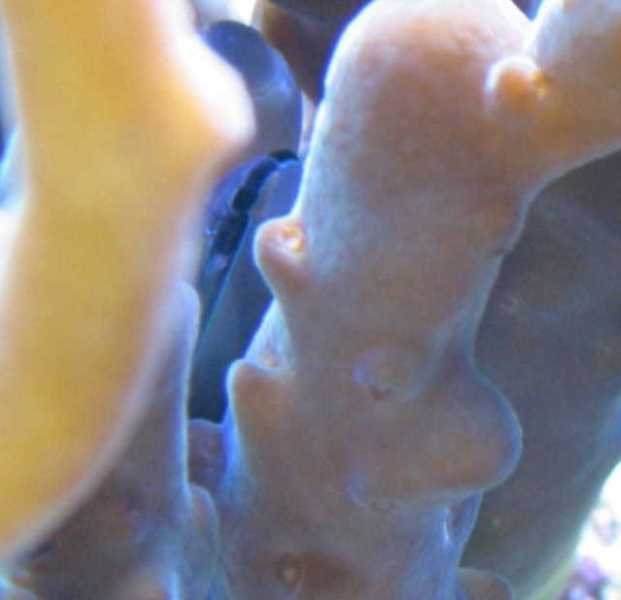
Les crustacés pourraient constituer une piste intéressante dans la lutte contre Amakusaplana acroporae. Lors des traitements spécifiques à l’iode ou au lugol en dehors du bac, nous prenions garde d’enlever les petits crabes commensaux (voir l’article de L. Colon) présents entre les branches des Acropora. Ces coraux présentaient un nombre de planaires inférieur aux Acropora sans crabe.

Les crabes pourraient jouer le rôle de déparasiteur en échange du gîte offert par le corail. Sans qu’ils cherchent à les manger obligatoirement, leurs mouvements incessants pourraient inhiber la fixation du parasite. Mais cette simple constatation n'est pas suffisante puisque il s'agissait d'espèces différentes d’Acropora, et que l'on peut penser que ces parasites s'attaquent préférentiellement à certains types d'Acropora, comme ce fût le cas par exemple pour le bac de Régis Doutres avec Acropora valida. Il semble qu'Acropora granulosa et apparentés, puissent également être des hôtes préférentiels d' Amakusaplana acroporae. Autre piste intéressante, Ellen Thaller, lors de la dernière conférence de Récif-France, proposait l’utilisation de Thor amboinensis (crevette « sexy » déparasiteuse) pour lutter contre ce parasite.
4.1.3. Autres prédateurs
Lorsqu’on recherche un auxiliaire naturel d'un organisme, on le trouve souvent dans le même phylum (même famille, même genre, même groupe…). Ainsi, certains Opistobranche sont des prédateurs d’autres Opistobranches : Facelina, Gymnodoris, Hermissenda, Paliolla, Phidiana, Pseudovermes, Roboastra. Il existe également des copépodes (crustacés, Ismaila) parasites de nudibranches. Ces copépodes appartiennent à la famille des Splanchnotrophidae et sont fortement spécialisés. Mais il nous était impossible de trouver ces prédateurs ou parasites et nous n'avons donc pas approfondi la question. Nous n'avons pas non plus effectué de recherche au sein de l'embranchement des plathelminthes. L'utilisation de ce type d'auxiliaire pose aussi quelques problèmes pratiques, on peut citer l’exemple de Chelinodura varians ou de Berghia verucicornis dont l’efficacité est souvent limitée par la conception même de nos bacs (pompes de brassage, écumeur...). Il serait quand même intéressant de tester l'efficacité de C. varians sur les planaires d'Acropora. Dans ce cas, on veillera à mettre les Acropora parasités dans un bac hôpital où le travail du nudibranche sera observé.
4.2. Lutte chimique
Lorsque l’utilisation de la lutte biologique est inefficace ou impossible, il est envisageable de s’orienter vers une méthode moins douce, la lutte chimique. On entend par lutte chimique l’application d'un produit, quel qu’il soit, pour détruire le parasite. Encore une fois, la méthode à privilégier consiste à évacuer rapidement les coraux cibles de l'infestation, comme l'a sagement fait Régis Doutres avec ses Acropora valida. Mais dans son cas, seul les A. valida étaient touchés. Chez nous, pratiquement tous les Acropora étaient attaqués (95%), et cela malgré une lutte commencée, à priori, quelques semaines seulement après l’introduction du parasite. Et on se voyait mal faire un bac SPS sans Acropora ni Montipora...

Nous avons utilisé des bains d’Iode pour lutter contre notre nudibranche. Pour éviter le développement de bactérie pathogènes, nous déposions quelques gouttes de lugol sur la bordure des parties attaquées. À noter que l’iode est photolabile (détruit par la lumière) et que les produits qui en contiennent doivent donc être conservés à l'obscurité. Un brossage était nécessaire (brosse à dent) pour éliminer tous les parasites. Les œufs étaient aussi éliminés mécaniquement. Mais, malgré un déparasitage régulier et complet de tous les Montipora, les parasites revenaient sans cesse. À l'évidence ce type de méthode ne peut être efficace avec des parasites dont les larves sont planctoniques. Nous avons donc décidé de jouer sur l'une des constantes du bac. Ne pouvant jouer sur la densité à cause de la présence de Sériatopora (qui résiste assez mal aux changements de densité), nous avons décidé de jouer sur le pH, en le faisant augmenter rapidement jusqu’à 9 environ (ajout de lait de chaux en grande quantité, une fois par semaine, pendant quatre semaines consécutives).

Cette méthode est très dangereuse surtout en présence d’ammoniaque, qui sous un pH élevé devient toxique pour les poissons et les invertébrés. De plus, à un pH de 9, il y a précipitation des ions Mg2+, Ca2+, PO42- dans le bac. Les constantes doivent donc être suivies attentivement et remontées par la suite. Cette solution a été mise en place dans un bac de 200l, et donc d'un volume raisonnable. Il n'est vraisemblablement pas envisageable de le faire sur un bac de 800l … Un traitement à l’eau osmosée (à température constante) n’a pas eu d’efficacité contre Phestilla. De plus, les dégâts occasionnés au corail sont importants et souvent irréversibles. Enfin, nous avons testé un traitement au lévamisole, sans grande efficacité non plus. Le traitement au Malafix (Tetra), pourtant un antibactérien à la base, semblerait montrer une certaine efficacité mais nous n'avons pas eu l'occasion de le tester. Le deuxième parasite, la planaire Amakusaplana acroporae, a été éliminé à la suite de l'utilisation successive de plusieurs méthodes. Pour localiser plus facilement ce parasite, il suffit de sortir la bouture de l’eau pendant quelques minutes et d’attendre qu’elle sèche (attention au courant d’air et au froid). La présence de zones ovoïdes restant humide et un peu brillante, vous indiquera l'emplacement des planaires. Le premier traitement a consisté à plonger les coraux dans des bains d’eau douce "flash" de quatre à cinq secondes (à la température du bac). Si le traitement a bien été efficace pour éliminer les planaires, il s'est montré pire que le mal pour certaines espèces d’Acropora, pour lesquelles une colonie sur deux, n'a pas supporté le traitement et a complètement nécrosé (Acropora granulosa en particulier). Ce traitement a été réalisé sur quatre boutures de 4 cm seulement. Une deuxième tentative a été faite en utilisant des bains d’eau à faible densité (1012) et en réduisant le traitement à une minute (communication personnelle, C. Seitz). Dans notre cas, le traitement s'est révélé peu efficace, une partie seulement des parasites tombant au fond du bac. Nous pensons toutefois que c’est une méthode à approfondir de manière à évaluer le meilleur compromis entre, la densité et la durée du traitement et les dégâts occasionnés au corail. Les planaires sont en effet des organismes très sensibles aux bains d’eau douce... mais les coraux aussi, et le stress occasionné peut être important. La perte de coloration est souvent totale. Michael Mrutzek conseils de réaliser des traitements à l’extérieur du bac, à base de bétadine (iode) à la dose de 2 ml de bétadine pour 1l d’eau. Les planaires se décrochent après un bain de 10 mn. Mais cette méthode ne nous a permis d’éliminer qu’une partie des planaires (les plus grosses et environ 50% de la population seulement).
Lars Sebralla propose l’utilisation d’un autre produit, le Polysept-Loesung, par trempage de l’animal parasité à l’extérieur du bac pendant 6 à 7 minutes. On recense en Allemagne plusieurs réussites avec ce produit. Il semble être à base d’iode et il est normalement utilisé comme désinfectant pour la peau. Nous n'avons pas réussi à nous le procurer et nous nous sommes dirigé vers un autre produit utilisé comme antihelminthique (action contre les vers) : le Lévamisole (Concurat). Ce produit est utilisé pour soigner des animaux contre des vers parasitaires, mais il est aussi connu pour son efficacité contre les planaires rouges classiques. C’est un puissant antihelminthique à utiliser avec prudence, puisque de nombreux problèmes ont été relatés, suite à son utilisation sur des bacs d’ensemble. Le dosage classiquement utilisé est de 7.5 g de chlorhydrate de Lévamisole à 10 % pour 500 litres d’eau dans un bac d’ensemble (pour une solution à 20 %, il n’en faudra que 3.75 g pour 500 litres.) Encore une fois, c’est un produit toxique, dont on ne connaît pas toujours les effets indésirables et il faut donc le manipuler avec précaution.
Malgré tout, et en désespoir de cause, l'invasion par les planaires d'Acropora étant toujours aussi importante, nous avons décidé de procéder à un traitement à base de solution de Lévamisole à 15 % trouvée en pharmacie, dans le bac d’ensemble (au dosage classique). Deux heures après le début du traitement (et une surveillance de tous les instants), de premiers symptômes de stress sont apparus sur le Chelmon rostratus. Il restait immobile au fond, les nageoires hérissées et avec une respiration très rapide. Il fût aussitôt pêché et introduit dans un bac hôpital prévu à cet effet. Il lui a fallu quelques jours pour recommencer à s'alimenter. Aucun autre poissons ou invertébré n'a eu de symptôme visible et il n’y eu aucune perte à déplorer. Le même jour, la moitié de l’eau de l’aquarium (après 6 h de traitement) a été changée et du charbon rajouté. Le Chelmon est actuellement toujours en vie. Il semble que les poissons réagissent différemment au Lévamisole. Tous les Chelmon n’y seraient pas sensibles. Un cas de perte de Zebrasoma flavescens a également été évoqué, sans que les autres poissons du bac réagissent. Il semble donc que chaque cas soit différent, sans lien particulier avec l’espèce. Nous n’avons plus jamais recommencé l’expérience, car au final il n’y eu aucun effet sur les planaires…
Il semble donc inutile et dangereux d'entreprendre un quelconque traitement au Lévamisole dans un bac communautaire. Nous avons par contre réalisé des traitements à l’extérieur du bac sur la base de 0.1 millilitre de Lévamisole 15 % pour 5 litres d’eau pendant 20 minutes. Le Lévamisole n’est pas sélectif et élimine tous les types de vers. À cette dose, les planaires se détachent et tombent. Mais il faut quand même gratter les œufs pour arriver à s'en débarrasser. Sur un seul Acropora branchu de quinze centimètres, nous avons dénombré 105 vers ! À cette dose, dans un bac hôpital, aucun dégât n’a été constaté sur les Acropora traités. Avant d’être réintroduit dans le bac, les coraux ont été rincés à l’eau de mer devant une pompe. Ce traitement a été répété une fois par semaine et tous les Acropora ont été traités en même temps. Le Lévamisole a une durée de vie limitée à environ 6 mois après ouverture et doit être conservé dans de bonnes conditions (dans le noir et au réfrigérateur).
La lutte contre ces planaires a pris fin suite à un déménagement qui nous a conduit a isoler pendant 15 jours les Acropora dans un bac hôpital, non relié au bac principal. Ce bac a été traité au Lévamisole de façon répétée tous les 2 jours. De l’iode à 10 % a été rajouté afin de limiter une éventuelle prolifération bactérienne. Avant tout traitement, il est impératif d’enlever délicatement les crabes présents sur les coraux, faute de quoi leur mort sera certaine. Il nous reste actuellement des Acropora ayant subi ces traitements, et depuis 1 an et demi, nous n’observons plus, ni symptôme, ni parasite.
L’association de deux méthodes devrait permettre d’obtenir de meilleurs résultats, mais en courant le risque d'un stress accru pour le corail. Un bain dans de l’eau à faible densité (1012), associé à 10 gouttes de lugol pour 5 litres d’eau pendant 5 minutes devraient montrer des résultats intéressants. Enfin, d’autres produits, utilisés dans d’autres pays (mais non testés par nous), ont été relevés sur des sites Internet. Ces produits seront toutefois très difficiles à trouver en France et nous ne connaissons pas leurs répercussions sur les animaux. Avant tout emploi curatif, des tests à différentes doses et sous différentes conditions (durée du traitement) doivent être pratiqués. Encore une fois, un traitement global du bac n’est pas conseillé et il faut donc disposer d'un bac annexe.
| Produits | Dosages | Durée | Efficacité | Source |
|---|---|---|---|---|
| Tetra marin Oomed | 1 à 30 fois la dose | 1h | Variable |
Reefland.com Bostonreeefers |
| Salifert flatworm | 1 à 30 fois la dose | 1h | Variable | |
| Seachem Reef Dip (iode) | 3 fois la dose | 10 mn | Assez bonne | |
| Prazipro praziquantel | ? | ? | Anti protzoaire ? | Site Maast |
| Flüke tabs | normale | 1h30 | Assez bonne | Site Reefcentral |
Il existe d’autres produits antihelminthiques mais dont le comportement en eau de mer est peu connu (Praziquantel, Mébendazole, Flubendazole). Ces produits ne sont délivrés en principe que sous ordonnance vétérinaire. De plus, ces produits ont un large spectre d’action et de nombreux invertébrés (crustacés, échinodermes…) ont toutes les chances de périr.
| Types de traitements | Traitement de Phestilla minor | Traitement de Amakusaplana acroporae | ||
|---|---|---|---|---|
| Effet sur Phestilla minor |
Effets sur le corail Montipora | Effet sur Amakusaplana acroporae | Effets sur le corail Montipora | Effet sur Amakusaplana acroporae |
| Lutte biologique | ||||
| Poissosn Thalassoma haradwicke | Aucun effet | Aucun effet | Prédation non testée | Aucun effet |
| Crabes commensaux, crevettes (Thor amboinensis) | Aucun effet | Aucun effet | Prédation ? | Aucun effet |
| Copépodes parasites | Non testé | Aucun effet | Non testé | Aucun effet |
| Lutte chimique (en bac hôpital) | ||||
| Eau douce (traitement flash) | Efficace | Aucun effet | Efficace | Sensibilité forte |
| Eau de faible densité (durée : 1 mn) | Efficacité faible | Aucun effet | Efficace hétérogène | Effet différent selon l'espace |
| Iode | Efficacité faible | Aucun effet | Efficacité faible à forte | Aucun effet |
| Betadine / Lugol | Efficacité faible à forte | Aucun effet | Efficacité faible à forte | Effet faible |
| Hydroxyde de Ca (pH élevé) | Efficace | Aucun effet | Aucun effet | Aucun effet |
| Lévamisol | Efficacité faible | Aucun effet | Efficacité très forte | Aucun effet |
| Polysept-Loesung | Non testé | Non testé | Non testé | Non testé |
| Résultats observés dans un cas spécifique, selon des conditions particulières, le résultat est partiellement subjectif. | ||||
4.3. Lutte préventive
Elle représente le meilleur moyen d’endiguer la propagation de ces parasites. Il faut toutefois identifier rapidement la cause du problème afin d’isoler l’individus malade. Dans l'idéal, un bac d’observation de quarantaine permettrait de suivre l’évolution du nouveau corail avant son introduction définitive. Mais cela veut dire doubler une partie du matériel, car ce bac doit être isolé du bac principal, tout en permettant de maintenir les coraux isolés dans de bonnes conditions. L’autre possibilité est de réaliser un traitement préventif avant toute introduction de coraux. Systématiser ce type de traitement se révèle le plus souvent inutile : tous les coraux ne présentent pas de maladies ou n’ont pas de parasites. Mais il permettrait d’endiguer à la source un éventuel problème. Un examen visuel attentif du corail que nous achetons, ainsi que des animaux voisins devrait permettre d’éviter l’introduction de certains parasites. Il en est de même, quoique plus rarement, lors de l’introduction de nouvelles boutures, mais il reste parfois difficile pour les aquariophiles de localiser et d’identifier certains parasites. La bonne connaissance du bac, des parasites et des maladies des animaux que nous maintenons, devrait nous éviter d'introduire ces pestes aquariophiles et d'endiguer leur dispersion. Encore faut-il savoir reconnaître les divers parasites et leurs symptômes.
5. Conclusion
A l’heure où nous écrivons cet article, nous n’avons heureusement plus ces parasites dans notre bac. L’identification dans le magasin des animaux atteints nous permet d’éviter de réintroduire ces organismes (très fréquents en magasin aquariophile). Malgré ces précautions, nous avons à nouveau été infesté, il y a quelques mois, par un autre parasite. Nous venons de nous en débarrasser, en réalisant des traitements à large spectre d’action (plusieurs semaines sans symptômes et surtout recolonisation des parties nécrosées). Nous n'avons pas de certitude sur l'identification du coupable mais nous soupçonnons une attaque de copépodes parasites d'Acropora. Mais ceci est une autre histoire. Même si les avancées techniques sont indéniables et parfois indispensables, il ne faut pas oublier que chaque bac est un petit écosystème à part entier et qu'il évolue en permanence, selon des critères biotiques et abiotiques. Les interactions biologiques sont très nombreuses et chaque introduction doit être surveillée afin de contrôler l’évolution des différents organismes. L’observation est indispensable pour tout aquariophile.
Notre plus grande crainte concernait l'existence d'une phase de conservation de ces parasites. Si cela avait été le cas, l'avenir des coraux de notre bac aurait été problématique. Chez de nombreux organismes, appartenant à des espèces totalement différentes, les oeufs sont la forme de conservation de prédilection (Nématodes). Notre inquiétude était donc grande lorsque les premiers oeufs furent découverts, car si malgré l’absence de leur hôte, les parasites réussissaient à survivre dans le bac (sur les pierres vivantes, les autres coraux…), nous pouvions être amenés à devoir nous passer définitivement des Montipora et des Acropora. Tout traiter aurait été illusoire et surtout inutile. Même si cette solution nous a traversé l’esprit, nous avons quand même décidé de n'effectuer les traitements qu'en bac hôpital. Depuis novembre 2004, les coraux de notre bac ne présentent plus aucun symptôme. C'est également le cas des coraux survivants (six espèces différentes de Montipora et cinq espèces d’Acropora) dont la coloration et la croissance sont normales. Enfin, aucun de ces deux parasites n’a été détecté depuis cette date. A priori, nous nous sommes donc débarrassés de ces parasites et cela notamment grâce aux traitements chimiques. Si ces traitements se sont révélés efficaces, c’est certainement parce qu’ils ont pu être ciblés sur le parasite identifié au préalable, appliqués sur un laps de temps suffisamment long, et à des doses relativement élevées, dans un bac hôpital. Toute intervention sur un bac doit être faite avec la plus grande prudence, notamment lorsqu'on utilise des produits chimiques pour lutter contre les parasites des coraux et des poissons. Nous n’aurions pas pu utiliser les mêmes dosages en bac d’ensemble. Rappelons que chaque bac est un écosystème à part, et présente des caractéristiques particulières, du fait notamment d’une filtration (origine des pierres vivantes), d’une population, et d’une maintenance propre à chacun. Chaque aquarium répondra donc au traitement de façon différente, et on ne peut pas tirer de généralités de l’utilisation d’un produit. Cela s'est vérifié dans notre cas avec l’utilisation du Lévamisole, qui a bien failli tuer certains de nos poissons. C’est pourquoi nous insistons sur la nécessité de traiter les animaux atteints d’un bac hôpital.
Notre hobby dépend le plus souvent de prélèvements effectués dans le milieu naturel. Il est donc important de tout faire pour maintenir les poissons et les coraux dans de bonnes conditions afin de minimiser les pertes au maximum. Si un animal est malade, parasité, nous devons nous donner les moyens de le sauver. Bien sûr, nous ne connaissons pas tous les parasites. Mais les moyens de communication actuels permettent de faire évoluer ces connaissances. Trop souvent, on entend dire "laissons faire la nature, il vaut mieux ne pas intervenir", mais il ne faut pas oublier que nos bac sont des écosystèmes clos et que nos animaux n’ont pas la liberté de changer de territoire pour, par exemple, se mettre à l'abri d'une pression parasitaire trop importante. Nos bacs ne recèlent pas non plus la biodiversité de l’océan en organismes auxiliaires et déparasiteurs. L’emploi de traitements ne doit surtout pas être systématique, mais adapté à la situation. L’expérience personnelle et les échanges entre aquariophiles doivent nous permettent de définir cette limite. Il peut être parfois inutile de traiter un poisson pour quelques points blancs, mais lorsque celui-ci présente d'autres symptômes alarmants, on se doit de réagir. Et agir dès le début de la crise est souvent source de réussite. Si nous n'étions pas intervenus et au vu de la vitesse de propagation, il est clair que dans notre cas, ces deux parasites auraient éliminé tous les Montipora et Acropora en seulement quelques semaines. Nous aurions pu laisser faire et nous contenter de récupérer des boutures chez des amis une fois la crise passée. Mais il est quand même plus satisfaisant pour nous d’avoir réussi à identifier ces parasites, puis à les éliminer pour pouvoir aujourd’hui contempler nombre de nos coraux qui ont survécu à toutes ces attaques parasitaires.
6. Références bibliographiques
Ouvrages
- Behrens D.W., 1991. Pacific Coast Nudibranchs. Sea Challengers, California, 107 pp
- Coleman N. 1989. Nudibranchs of the South Pacific. Sea Australia Ressource Centre, Springwood, Australia, 64p.
- Colin P. L., Arneson C., 1995. Tropical Pacific Invertebrates, a field guide to the Marine Invertebrates. Coral Reef Press, 295p.
- Debelius H., 2003. Guide du récif corallien Mer rouge. Edition Ulmer, 321p.
- Delbeek J. C. et Sprung J. 1997. L’aquarium récifal. Tome 1, Ricordea Publishing, 543p.
- Delbeek J. C. et Sprung J. 1997. L’aquarium récifal. Tome 2, Ricordea Publishing, 546p.
- Delbeek J. C. et Sprung J. The Reef Aquarium. Tome 3, extrait.
- Maxant F., Quignard J. P., Gantès R. ed., 2004. Thau oasis de vie : écosystèmes, patrimoines et paysages sous marins. Edition Biotope, Mèze, 224p.
- Yonow N. et Hayward P.J. 1991. Opistobranches de l’ile Maurice, avec la description de deux espèces nouvelles (Mollusca : Opistobranchia). Revue française d’aquariologie herpetologie. N°18. p 1-30.
- Yonow N. 1994. Opistobranchs from the Maldives Islands, including descriptions of seven new species (Mollusca : Gastropoda). Revue française d’aquariologie herpétologie. N°4. p 97-129.
- Yonow N. 1996. Une brève revue du régime alimentaire des Nudibranches et Sacoglosses (Mollusques Opistobranches). Revue française d’aquariologie herpétologie. p 77-84.
Sites internet consultés
Life at the edge of reef
Lars sebralla
Medslugs
Nembro
SEBRALLA Lars. Bekämpfung von Strudelwürmer auf Acropora-Arten. Ratgeberteich
GRAY tracy. Elimination of a predatory nudibranch. Reeffarmers
Reefkeeping
Okinawa slug site
Marine flatworms of the world
Saltcorner
Seaslugs, nudibranchs, opisthobranchs and their allies
Seaslugforum
MORIN Antoine. Animaux : Structures et fonctions - Les Plathelminthes. Bio 2525. Université d'Ottawa, Biologie. 2002
Slug site
Laetitia COLON et Olivier SOULAT
Article actualisé par les auteurs et publié par Cap Récifal le 08 novembre 2013 avec l'aimable autorisation des auteurs.Publié initialement le 26/09/2006 sur Récifs.org.







Commentaires recommandés
Il n’y a aucun commentaire à afficher.