
1 : Classification, anatomie - 2 : Nutrition, reproduction - 3 : Écologie - 4 : Maintenance
La lecture des articles précédents ne réserve aucun suspens : la maintenance des Octocoralliaire est essentiellement liée à leur nourrissage. "Comme tout être vivant" direz-vous : oui, sauf que ces coraux, se nourrissent plus ou moins facilement selon qu’ils sont photosynthétiques ou pas.
Les Octocoralliaires zooxanthellés, reçoivent l’essentiel de leurs nutriments via les zooxanthelles qui utilisent l’énergie lumineuse. Un aquarium récifal doté d’un éclairage adapté à la maintenance de poissons suffit à leur fournir cette énergie, le complément de nutriments étant facilement obtenu par le produit de la dégradation des matières organiques et/ou la présence de plancton qui s’y développe. Sauf rares exceptions, l’aquariophile n’a pas nécessité de réaliser des apports particuliers de nourriture, et ces Octocoralliaires, un peu privilégiés, ne sont pas en quête constante de nourriture. Mais la situation est bien différente avec les espèces non photosynthétiques (NPS), sessiles, suspensivores pour lesquels le nourrissage est le cœur de leur maintenance. Cet article traitera donc des dispositions à mettre en œuvre en réalisant un focus sur les Octocoralliaires azooxanthellés.
1. Conditions préalables
La vie de ces animaux à l’état sauvage dépend de la trilogie : facteurs extérieurs / biocénose / biotope. Tout naturellement, ces règles doivent être respectées de la même manière pour notre écosystème captif : aquariophile / vivant / système de maintenance.
1.1. Facteurs extérieurs → l’aquariophile
Les facteurs extérieurs réunissent tous les évènements subits par les animaux et leur environnement. Dans un système captif, c'est bien par l’aquariophile que tout commence et c’est aussi lui qui agit et réagit aux évènements. Comme pour tout ce qui touche à la maintenance du vivant, les choix initiaux sont suivis d’effets qui dépassent notre simple satisfaction personnelle. Notre responsabilité est encore plus grande quand il s’agit d’espèces sauvages, prélevées dans leur milieu naturel, comme il en existe encore de nombreuses, proposées à la vente.
Si certaines espèces disposent d’une capacité d’adaptation aux variations du milieu environnant, d’autres supportent bien moins les fluctuations. Le système doit donc être conçu de manière à assurer tous les besoins des espèces et de manière régulière et pérenne. Concernant l’aquariophile, il ne s’agit pas seulement du budget pour la mise en place et la maintenance, mais aussi du temps qu’il peut y consacrer, de l’attention qu’il peut porter ou de sa réactivité… au début et dans les années qui suivent. En captivité, la cause principale des dérives est bien… l’aquariophile, lui-même. La santé et le bien-être d'un aquarium et ses habitants sont fondamentalement liés à sa connaissance de la biologie des organismes et à son niveau d’expérience. La lecture de revues, d’articles, le soutien des membres des forums spécialisés ou de ceux d’un club aquariophile sont indispensables. Le risque est fortement réduit quand l’aquariophile conçoit de manière réfléchie son installation (volume de cuve, éclairage, brassage, nourrissage, traitements…) pour des objectifs donnés (espèces hébergées, esthétique, ambiance…) en incluant l’ensemble des risques (dérives, pannes…) et les ressources (budget, disponibilité, rapidité d’intervention…), qu’il est prêt à consacrer, ceci depuis le début du projet et durant l'hébergement des individus.
Bref, la décision de se lancer dans l’aventure récifale et la mise en œuvre des moyens pour qu’elle soit une réussite, méritent d’y réfléchir posément, auparavant. La première question s'impose : suis-je réellement prêt pour l’aventure ?
1.2. Biocénose → le vivant
La biocénose est l'ensemble des êtres vivants coexistant dans un même milieu : faune, flore et microorganismes. Parmi les critères de choix des habitants de l'aquarium, il y a bien évidemment la difficulté de leur maintenance telle qu’elle est reconnue par les récifalistes, selon leur caractère symbiotiques ou pas et la capacité pour le polype à ingurgiter des proies variées. Mais d’autres paramètres comme le régime alimentaire, la qualité de l’eau, leur positionnement, l’origine mariculture ou sauvage…, pourront amplifier la tâche.
Les articles qui précèdent nous ont aidés à mieux connaître leur fonctionnement et leurs besoins généraux. Ce qui suit donnera des pistes pour assurer leur bien-être en harmonie avec les autres animaux hébergés et pour les multiplier. Mais il restera à s’interroger sur les exigences spécifiques de chaque individu, afin de déterminer la nourriture optimale. Certaines espèces ont un régime particulièrement restreint et les données n’étant pas toujours disponibles, l’aquariophile devra parfois s’investir dans de vraies recherches… ou passer son chemin.
1.3. Biotope → le système de maintenance
Le biotope détermine les conditions de vie du vivant. Parmi les biotopes envisageables pour les Octocoralliaires, il est rarement question de crête récifale mais d’environnements plutôt protégés des vagues, soit par la configuration du milieu ou du fait de la profondeur, avec des flux hydrodynamiques relativement réguliers. Ils seront plus ou moins éclairés et chargés en nutriments : pente récifale, début du plateau continental, lagons, passes avec des configurations locales adaptées (grottes, failles, tombants, surplombs…).
L’aquarium ne peut, encore aujourd’hui, répondre à toutes les exigences de toutes les espèces. Il suffit d’observer les aquariums publics, soucieux de recréer les biotopes spécifiques des espèces hébergées (eaux froides, eaux tropicales, lagon, crête, pente récifale, etc.). Soyons honnêtes, le choix du biotope est parfois d’abord esthétique, conditionné par le décor imaginé, en harmonie avec le salon ou par l’ambiance qu’il dégage (une plage de sable lagonaire ne dégage pas la même sensation que le tombant d’une passe récifale). De manière plus naturelle, il peut aussi émaner de l’envie d’héberger certaines espèces particulières.
Mais quel que soit l’écosystème naturel choisi, ses éléments (décor, lumière, brassage, nutrition…) doivent être conçus en relation avec le monde vivant qui l’occupe. Les coraux n’échappent pas à la règle. L’article Octocoralliaires 3 – Écologie donne un aperçu de la répartition des espèces et les publications spécifiques permettront de déterminer au mieux le couple biotope/espèces.
Finalement cela ne parait pas si compliqué ! Alors entrons dans le cœur du sujet.
2. Système de maintenance

On a pu constater de nombreuses avancées technologiques débouchant, de la part des fabricants, sur des équipements de plus en plus performants et fiables ; les chercheurs communiquent mieux sur les organismes marins ; les processus de maintenance s’améliorent de même que les tests de contrôle ainsi que la compétence des récifalistes amateurs. De nombreuses espèces sont maintenues alors qu’elles semblaient inaccessibles il y a quelques années. Mais tout n’est pas encore possible. L’aquarium futur doit être réfléchi, aussi nous allons passer en revue les dispositions connues à ce jour pour proposer un système épanouissant, plus précisemment, un milieu dont tous les éléments (brassage, éclairage, paramètre de l’eau…) seront conçus pour que le polype ait envie de s’épanouir.
2.1. Température
Pour les espèces tropicales de surface, d’une manière générale les températures de 24 à 25°C conviennent ; pour les coraux azooxanthellés de profondeur une température inférieure, de 20 à 22°C, est préférable. Les températures plutôt basses limitent la dépense énergétique consacrée au déploiement des polypes et à la capture. La concentration d’oxygène y est aussi plus importante. Elles limitent également les contaminations par les virus et les bactéries. Selon le biotope (tropical ou eau froide), le type d’installation, la production de chaleur par l’éclairage (HQI, T5, LED), l’isolation de l’habitation, le lieu géographique… un moyen de refroidissement pourra permettre de passer les canicules. Un aquarium dédié aux Octocoralliaires azooxanthellés, moins éclairé, nécessitera un équipement de moindre puissance.
2.2. Hydrodynamique et brassage
2.2.1. Vitesse d’écoulement
La circulation de l'eau est essentielle pour les organismes sessiles surtout si ce sont des filtreurs comme les Octocoralliaires ; elle apporte les nutriments dissous ou sous forme particulaire ; elle assure les échanges gazeux : l’apport de dioxygène comme l’évacuation du dioxyde de carbone ; elle entretient les échange thermiques et contribue à l'élimination des sédiments.
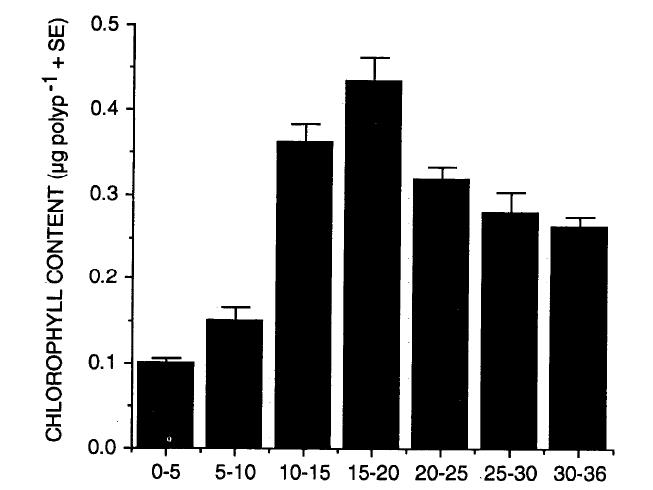
La vitesse d’écoulement du courant affecte le nourrissage, il a des effets bénéfiques ou au contraire néfastes sur l’alimentation du corail. À de trop faibles vitesses, les particules ne rencontrent pas suffisamment les polypes ou ne provoquent pas le déclenchement de leur ouverture. Des débits élevés augmentent l'afflux de particules alimentaires, mais trop importants, ils augmentent leur vitesse, limitant l’efficacité de la capture des proies qui glissent sur les polypes. De plus, ces derniers plient et leur surface de capture est réduite d’autant. Lorsque le courant est trop important, les polypes s’épanouissent d'avantage à l’opposé du courant et leur durée d’ouverture se raccourcit.
Ces mécanismes expliquent pourquoi, sur plusieurs espèces de coraux, on a pu mesurer une plage de débit optimale pour la capture de proies, se situant entre 5 et 15 cm/s. Les alcyonnaires seraient plus réceptifs à une vitesse entre 8 et 15 cm/s. Les vitesses d'écoulement optimales (tableau 1), sont classées selon leur valeur : lentes (L) > 5 cm/s ; modérées (M) : de 5 à 15 cm/s ; rapides (R) : de 15 à 30 cm/s et très rapides (TR) > 30 cm/s.
| Espèces | Vitesse | |
|---|---|---|
| Acanthogorgia vegae | M | 8 |
| Briareum asbestinum | M | 6 à 12 |
| Eunicea tournefortis | M | 6 à 12 |
| Melithaea ochracea | M | 8 |
| Plexaurella dichotoma | M | 6 à 12 |
| Pseudopterogorgia americana | M | 6 à 12 |
| Subergorgia suberosa | M | 8 |
| Dendronephthya hemprichi | R | 10 à 25 |
Bien que de nombreux coraux prospèrent à des vitesses de courant variables, chaque espèce ou même le génotype au sein d’une espèce, peut préférer un débit spécifique. Ce débit optimal dépend en partie de la densité de particules alimentaires disponibles dans le milieu. Par exemple Acanthogorgia vegae, Melithaea ochracea et Subergorgia suberosa, qui partagent le même habitat, capturent mieux le zooplancton lorsque la vitesse du flux est de 8 cm/s. En outre, Subergorgia suberosa ne capture la nourriture que dans une plage très étroite, ce qui rend sa maintenance très difficile. L’optimum de capture chez les Octocoralliaires phytoplanctophages se situe à des vitesses plus rapides : Dendronephthya hemprichi, qui consomme essentiellement du phytoplancton, se nourrit et se développe de façon optimale entre 10 et 25 cm/s. Ses polypes sont très déployés et son métabolisme est maximal à 17.5 cm/s ; il réduit de 50 % à 7.5 cm/s.
2.2.2. Taille et morphologie de la colonie
La structure ramifiée de nombreux coraux réduit l’écoulement de l'eau et la pénétration de la lumière à l’intérieur et dans la partie inférieure de la colonie. Ainsi, les grandes colonies exigent plus de lumière et de flux d'eau pour maintenir des taux de photosynthèse et des échanges gazeux acceptables. En même temps, au fur et à mesure de sa croissance, la biomasse de la colonie augmente et nécessite une quantité plus importante d’aliments. Ceci étant, le taux de nutrition de la colonie diminue globalement au fur et à mesure qu'elle se développe. Ces phénomènes expliquent en partie que les grandes colonies se développent moins vite qu’à leur début. En aquarium, la taille des colonies ou leur ramification importante doivent être compensées par un brassage amélioré. Par contre, en aquaculture le but est autre : les colonies doivent être maintenues à une petite taille où la croissance est la plus rentable.
2.2.3. Brassage des Octocoralliaires zooxanthellés

Les algues symbiotiques sont en mesure de fournir une bonne proportion des besoins énergétiques nécessaires, le brassage ne revêt donc pas une importance cruciale en ce qui concerne le nourrissage. Mais on l’a vu dans Octocoralliaires 2 - Biologie : nutrition, reproduction, les besoins des espèces dont la biomasse est importante, sont très rarement totalement assouvis avec la seule énergie lumineuse. De plus, les Octocoralliaires étant des invertébrés sessiles et suspensivores microphages, ils ont toujours besoin de brassage pour assurer une part de leur nutrition, l’oxygénation ou la dé-sédimentation de leurs tissus. Cependant, la majorité des espèces occupe des zones peu exposées aux vagues : même s'ils ont une certaine capacité à s’adapter aux mouvements d’eau, ils n’apprécient guère les flux cisaillants et turbulents tels que les produisent les pompes centrifuges à aubes de type Turbelle de Tunze.
Certaines espèces habituées des lagons, se satisfont de courants faibles, l’oxygénation des tissus est alors en partie assurée par les mouvements ondulatoires de la houle. Pour ce, le brassage par boite à vague permet d’assurer une certaine circulation d’eau au contact des tissus, mais comme il ne permet pas à lui seul le renouvellement des gaz, de la nourriture et des nutriments dans l’environnement du corail, il sera réservé aux espèces zooxanthellées. Ou bien, de la même manière que les mouvements de marées assurent les échanges entre le lagon et la pleine mer, il sera complété par un autre système de brassage à flux large tel que le produisent les pompes axiales à hélices de type Stream de Tunze.
En général, les espèces zooxanthellées croissent rapidement dans des conditions de brassage simplifiées telles que ci-dessus. Pour les raisons expliquées plus haut concernant les grosses colonies, comme pour les espèces azooxanthellées, le brassage doit être adapté et les principes exposés ci-après s’avèrent utiles.
2.2.4 Brassage des Octocoralliaires azooxanthellés
Concernant les Octocoralliaires dépourvus de zooxanthelles, le brassage devient le seul élément permettant d’assurer les apports nutritionnels et revêt une importance primordiale. Pas question ici de formuler le brassage par un simpliste ratio « débit des pompes / volume du bac ». Les conditions à réunir sont bien plus complexes :
2.2.4.1. Écoulement tourbillonnaire massif (vortex, gyre)
L’aquariophile récifal qui tente de restituer les flux énergiques du sommet d’une pente récifale, a l’habitude d’exposer les colonies de Scléractiniaires aux flux de pompes directionnelles avec parfois des impulsions et des directions variant sans cesse. Il en résulte un flux chaotique, turbulent, qui n’a pas le temps de prendre de la vitesse et dont l’énergie est rapidement freinée par le décor, au détriment de colonies plus en arrière, qui n’en profitent pas. L’efficacité d’une pompe de brassage peut ainsi être réduite à néant, quelques dizaines de centimètres plus loin.
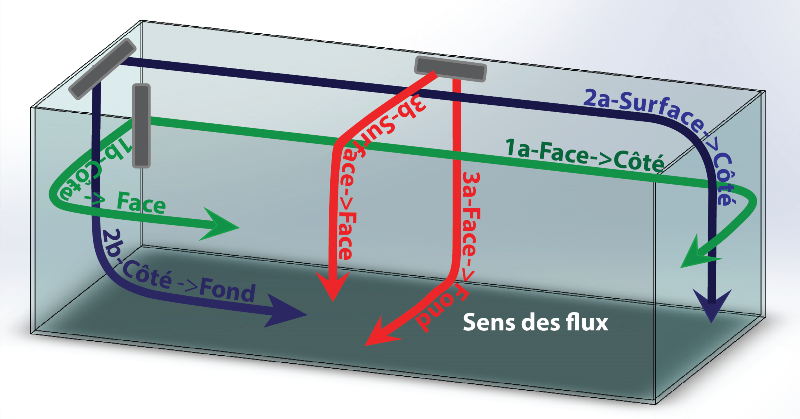
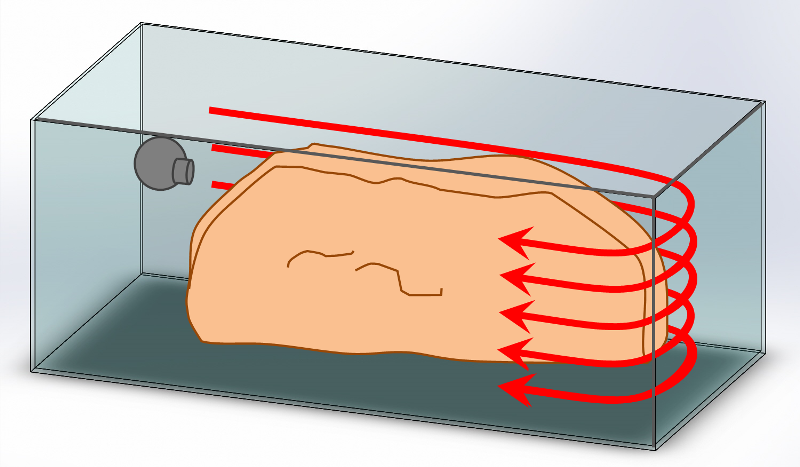
Une masse d’eau qui se déplace dans son ensemble, est de nature à mieux brasser chaque zone du volume, jusqu’aux interstices du décor. Une solution simple consiste à mettre en rotation la colonne d’eau de l’aquarium autour de son axe (vertical ou horizontal), et de l’entraîner dans un mouvement circulaire dit « mouvement tourbillonnaire ». L’inertie de cette masse permet d’entretenir le mouvement avec une moindre dépense énergétique. Selon l’agencement des spécimens dans la cuve, on peut choisir un mouvement de rotation parmi six en fonction de l’orientation de la sortie de pompe (Illustration). La poussée des pompes sera mieux exploitée en agissant directement sur une grande longueur (cas 1a et 2a). Les frottements à la surface de l’eau étant inférieurs à ceux des vitres, le mouvement giratoire sera entretenu avec moins d’énergie si la pompe est orientée vers la surface (cas 2a et 3b). La sortie de pompe dirigée vers le fond (cas 2b et 3a) maintiendra mieux les particules de nourriture en sustentation et soulèvera celles qui se seront déposées au fond. Une circulation autour du bac, contournant le décor, atteint plus facilement l’ensemble des coraux exposés (cas 1a).
Cet écoulement tourbillonnaire, qui n’est pas sans rappeler les cercles formés par les grands courants océaniques gyres, nécessite que les pompes l’entretiennent en fonctionnant simultanément dans le même sens. L’aquarium revêt aussi une importance : un petit volume, des obstacles proches qui génèrent des frictions, une forme cubique aux faces rapprochées.. ne favorisent pas la création d’un mouvement, ni son maintien.
2.2.4.2. Écoulement laminaire
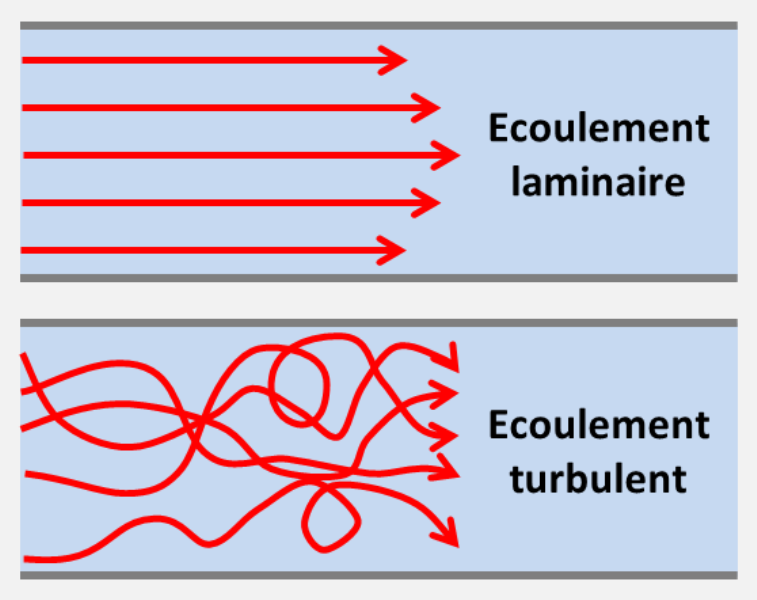
Les polypes se déploient en fonction du courant, quand celui-ci est stable en direction. On parle alors d’écoulement laminaire, c’est-à-dire que les particules fluides voisines, restent voisines (la notion de flux laminaire horizontal ou vertical n’a pas de sens, un flux est ou n’est pas laminaire).

L’écoulement laminaire peut être obtenu partiellement avec une pompes axiale à hélices de type Stream ou plusieurs pompes centrifuges à aubes de type Turbelle, réparties sur la hauteur de l'aquarium, dont les flux viennent lécher la vitre latérale, avec les pertes d’énergie que cela induit. Mieux encore, les pompes à flux laminaire de technologie Crosflow, (Maxspect Gyre ci-contre), semblent parfaitement adaptées à cet usage, elles créent un mouvement tourbillonnaire autour du bac, dont le sens dépend de la position de la pompe. Un système en circuit fermé (closed loop) aura le même effet dans un gros volume. Pour un petit volume, on peut connecter la sortie d’une pompe de type Turbelle sur une canne de rejet (ou de refoulement) percée pour obtenir un effet approchant.
Un flux laminaire peut également être obtenu en agençant le décor de telle sorte que l’eau soit de direction et d’intensité uniformes au contact des invertébrés, par exemple le long de parois, entre des failles, à l’intérieur de grottes tubulaires.... Certes, la notion de courant laminaire est toute relative dans nos aquariums. Il est transformé en mouvement turbulent dès lors qu’il rencontre un obstacle, ne serait-ce qu’une branche de corail. Cette transformation est amplifiée lorsque la vitesse initiale est grande, un mouvement d’eau massif et lent conservera donc mieux son caractère laminaire, laissant toute aptitude au polype d’adapter sa position pour créer le meilleur courant de convection qui permettra la capture de nourriture.

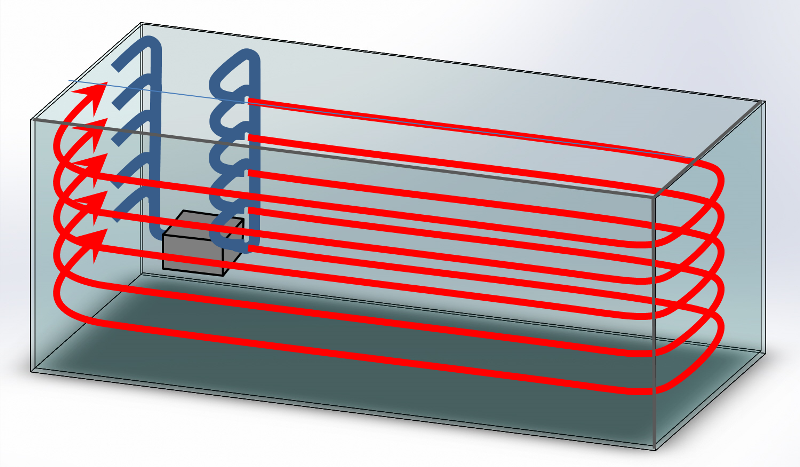
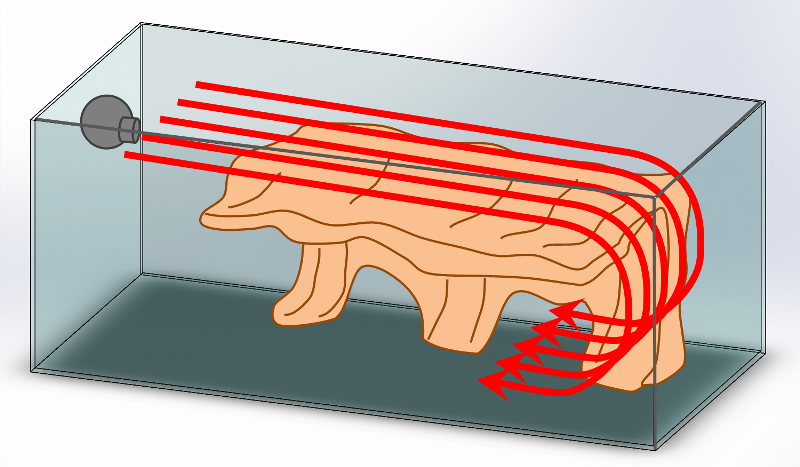
2.2.4.3. Directions adaptées

Selon l’orientation de la pompe, le flux hydraulique pourra prendre des directions et des sens différents (Illustration). Le choix dépendra de l’objectif visé. La circulation de l’eau pourra être horizontale : chaque particule reste dans un plan horizontal et tourne autour de la cuve (cas 1) ou au contraire verticale : chaque particule d’eau reste dans un plan vertical (cas 2 et 3). Le flux sera le plus laminaire si la sortie de la pompe est orientée le long d’une grande longueur libre (cas 2a et 1a si la face arrière est dégagée). Ce ne sera pas le cas s’il vient trop vite buter contre une face opposée (cas 1b et 2b) ou un élément du décor. Toute autre orientation répondra moins bien à l’objectif de brassage laminaire visé, mais certaines configurations peuvent toutefois présenter quelque intérêt : Un flux dirigé depuis la face arrière vers le fond (cas 3a) deviendra très vite turbulent mais dégagera le dessous du décor de tous les sédiments qui auront pu s’accumuler pour les faire remonter en surface ; de même un flux dirigé depuis la surface vers la face avant (cas 2b) ne restera pas laminaire mais assurera de bons échanges gazeux au sein du décor. Un flux vertical léchant le fond (cas 2 ou 3) permet de conserver plus longuement les particules nutritives en suspension, disponibles pour ces filtreurs.
Pour la maintenance des suspensivores, le courant laminaire devrait idéalement remonter légèrement. Cela correspond mieux aux conditions naturelles et maintient plus longtemps en suspension les particules de nourritures. Le choix du flux peut également dépendre de la disposition des spécimens (fixés la tête vers le haut, le bas ou perpendiculaire au décor). Un système constitué de plusieurs pompes pilotées permet de jouer sur les différents tableaux.
2.2.4.4. Vitesse

Nous l'avons abordé plus haut : la vitesse du courant est importante, selon l’espèce (tableau 1). Cette vitesse ne doit pas être obtenue par une pompe dirigée trop près des spécimens, les fins tissus des gorgones azooxanthellées ne résisteraient pas longtemps. À contrario, des vitesses trop lentes favorisent la sédimentation sur ces tissus. Les déperditions de vitesse du courant sont rapides, provoquées par la pesanteur, la viscosité de l’eau, sa pression, son frottement contre les parois et le décor, le contact des colonies… L’agencement du décor permet de créer des zones plus ou moins rétrécies dont la vitesse sera ajustée à l’espèce fixée. Dans un aquarium mixte, on peut ainsi imaginer un décor horizontal (illustration) permettant un mouvement rapide en surface pour les espèces zooxanthellées et plus lent et régulier dans la partie inférieure pour d’autres azooxanthellées. Les courantomètres sont encore chers pour justifier leur investissement, mais la vitesse de l’eau dans les zones où sont placés les spécimens, peut-être mesurée relativement facilement, en chronométrant la distance parcoure par des particules en suspension, entre deux repères tracés sur la vitre.
2.2.4.5. Alternance du sens du courant
- Courant laminaire
- Vitesse adaptée à l’espèce
- Légèrement ascendant
- Direction stable
- Inversion de courant (marées)
- Phases d’accalmies
L’alternance du sens du courant permet de solliciter les tissus des coraux, de toutes parts et de favoriser leur respiration. Les invertébrés sessiles ont également besoin de l’aide des courants pour dégager les impuretés accumulées sur leurs tissus, les algues agrippées à leurs branches, les mucus ou les films cireux autonettoyants, phénomènes fréquents en aquarium. Un programmateur, un automate ou tout autre système d’asservissement pourra commander la mise en route de pompes ou bien l’ouverture de vannes dans un système de brassage en circuit fermé « close loop ».
Un écoulement tourbillonnaire constant aura pour effet négatif d’accumuler les sédiments au centre du vortex, c’est-à-dire le décor, et d’y rester avec les risques que cela représente pour la respiration des invertébrés sessiles et des bactéries qui le colonisent. On pourra y remédier en générant occasionnellement un brassage dans cette zone, couplé à une filtration mécanique.
2.2.4.6. Stabilité sur de grandes périodes

Pour mieux capter les particules, les polypes s’ouvrent et s’orientent selon la direction et l’intensité du courant. Le brassage doit donc être stable. Cette adaptation exige une dépense d’énergie de la part des invertébrés, cette stabilité est donc nécessaire sur de grandes périodes. Le principe des pompes pilotées en direction, vitesse et durée, réglées en mode marées, dont le sens d’écoulement change toutes les six heures ou plus, reproduit au mieux les échanges hydrodynamiques d’une passe récifale ou de courants venant de la pleine eau.
2.2.4.7. Phases de repos
Certains Nephtéidés comme Dendronephthya semblent mieux croître en présence d’accalmies comme celles constatées aux étals de basse mer et de haute mer ou comme avant une renverse de courant. Il faut considérer que la vitesse d'un courant de marée, n'est jamais constamment à son niveau maximal. Elle évolue constamment entre pleine mer et basse mer, en fonction de la hauteur d'eau. La vitesse est lente (1/12 du marnage) 2 heures à marées basse et haute et rapide (3/12 du marnage) 2 heures entre chaque marée (figure ci-contre). C'est à dire que les vitesses maximales ne sont finalement observées que 2 heures par cycle de 6 heures. Les puristes pourront ainsi reproduire, au moyens de simulateurs, les variations des vitesses du brassage suivant le même type de courbe sinusoïdale.
2.3. Éclairage
Les Octocoralliaires occupent des zones variées, depuis le haut du récif (certains genres tels que Sinularia sont exondés à fortes marées basses) jusqu’à des profondeurs importantes, dans des eaux plus ou moins turbides. Un aquarium n’atteint jamais parfaitement les conditions d'exposition des biotopes naturels (profondeur, turbidité, couverture nuageuse…), on doit cependant tenter d'y transposer leurs niveaux d’éclairement.
2.3.1. Octocoralliaires zooxanthellés

D’une manière générale, les Octocoralliaires zooxanthellés nécessitent moins de lumière que les SPS les plus exigeants et, n’occupant pas exactement les même niches écologiques, ils ne sont pas naturellement en réelle compétition pour la lumière. Certaines espèces acceptent plus facilement des eaux turbides, chargées et moins claires, mais dans un petit espace captif à des emplacements imposés, il peut en être autrement. Ne nous y trompons pas, certaines espèces réalisent malgré tout leur photosynthèse sous des éclairements non négligeables : il a été mesuré en captivité sur Sinularia densa une saturation de la photosynthèse à un PAR d’environ 207 µmol/m²/s, soit 10350 lux et un début de photoinhibition à 400 µmol/m²/s soit 20 000 lux, ce qui représente bien plus que certains SPS. Comme pour ces derniers, la plage de la photosynthèse et le seuil de résistance à la photo-oxydation sont variables selon les genres. Par exemple, Sinularia prospère également en eaux plus profondes à 40 mètres. Malgré le peu de mesures relatives aux Octocoralliaires, on peut estimer leur besoins moyens dans une plage de 70 à 300 µmol/m²/s (cf. article Mesure du PAR, ce qu'il faut retenir).
2.3.2. Octocoralliaires azooxanthellés
On pourrait penser que l’éclairage ne peut avoir d’incidence sur des organismes non photosynthétiques. Nous sommes loin de tout savoir sur leurs besoins en quantité ou spectre de lumière, ce dont nous sommes sûrs est qu’il n’est pas sans importance, de plus certains phénotypes dérogent aux standards observés. On sait par exemple que des Octocoralliaires non photosynthétiques comme Dendronephthya se développent en général dans des zones peu éclairées mais aussi dans des environnements proches de coraux photosynthétiques, au sommet de récifs et ne craindront pas la lumière d’un aquarium récifal, même éclairé sous HQI. Mais tout individu se laissera plus vite dépérir en cas de dépassement de l’intensité lumineuse admissible. De plus, trop de luminosité devient préjudiciable en faisant prospérer des organismes photosynthétiques, notamment des algues, qui envahissent le corail. De nombreuses espèces supportent un éclairage peu intense avec un PAR de l’ordre de 20 à 50 µmol/m²/s. Sans information sérieuse concernant l’importance du spectre lumineux, on peut se rapprocher de celui observé à des profondeurs de 10 mètres (violet à vert : 400 à 550 nm) jusqu’à 40 mètres (violet à bleu : 400 à 480 nm). Des récifalistes relatent des réactions positives sur des gorgones azooxanthellées Acanthogorgia sp. et Guaiagorgia sp. sous lumière de LED bleues à 460 nm. Certaines espèces enfin, voient leur croissance stoppée en présence de lumière.

La plupart des aquariums de NPS sont mixtes, de sorte qu’il faut y inclure un éclairage. Ne sachant pas toujours quel spectre et surtout quelle intensité sera appropriée à telle espèce, on peut envisager un éclairage dimmable. Les tubes T5 confèrent une lumière répartie, telle qu’on la trouve en profondeur. Les LED permettent des variations d’intensité et de spectre, relativement simplement. Les avancées dans la maintenance des NPS pourront justifier des éclairages dédiés à certaines espèces, au moyen de sources orientés vers leur position.
L’aquarium d’azooxanthellé est peu éclairé, à l’extrême il sera insuffisant pour pouvoir l’admirer. À cet effet, on peut prévoir d’augmenter l’éclairage momentanément dans la mesure où certaines espèces pourront le supporter, et même s’appuyer sur des jeux de lumière indirecte ou des éclairages à contre-jour, par exemple pour simuler la vision d’une grotte débouchant par l’arrière.
2.4. Cuve
En verre, en ciment ou en matériau acrylique, la conservation des espèces symbiotiques n’impose pas de limite de volume, les aquariums publics en hébergent dans des bassins de plusieurs milliers de litres.

Pour la conservation des NPS, le volume dépend de la capacité technique à distribuer correctement la nourriture en tous points. Le brassage n’est pas le facteur limitant avec les équipements proposés aujourd’hui, le mouvement d’eau massif tel qu’il a été décrit plus haut est d’ailleurs plus facile à obtenir dans des volumes importants. Mais les moyens d’épuration, biologiques ou autres, à l’intérieur ou à l’extérieur de l’aquarium doivent être en relation avec la quantité de nourriture distribuée, elle-même dépendante du volume d’eau et dont une partie a tendence à se déposer. Aujourd’hui, les récifalistes conservent les espèces non zooxanthellées considérées comme les moins difficiles, dans des volumes avoisinant les 500 litres.
On sait peu sur les conditions de maintenance de certaines espèces sensibles dont une partie devrait d’ailleurs rester dans le milieu naturel. Dans cette phase de prise de connaissance, on ne peut parler de maintenance mais plutôt d’analyse du comportement (cf. chapitre Accueil – observation). La cuve d’observation est alors de petit volume, environ 100 litres, permettant une vision rapprochée. C’est seulement après que les conditions de maintenance sont identifiées que les spécimens pourront évoluer dans un espace adapté, plus grand.
Dans la pratique, on trouve des cuves de formes et hauteurs variables. Pour les espèces non zooxanthellées, les chances de réussite seront augmentées avec une forme qui favorise la réalisation de courants laminaires. Dans les cuves longues, un système en circuit fermé (closed loop), permet d’entretenir la continuité du mouvement sur la totalité de la hauteur de la cuve. Sur les plus petites volumes, on peut plus facilement envisager un flux tournant autour du bac. Les cuves cylindriques ou polygonales dont les côtés sont égaux (carrées, hexa ou octogonales) et celles dont les angles sont arrondis, sont alors les plus adaptées.
Les Octocoralliaires, d’une manière générale, nécessitent une lumière moyenne à faible, la hauteur de l’aquarium peut donc dépasser 70 cm. Cependant d’autres facteurs, comme le brassage, la limitent en proportion avec les autres dimensions. La largeur doit permettre d’assurer les échanges gazeux, la surface doit donc être en relation avec le volume à mouvoir. Nous avons peu de recul pour définir les meilleures dimensions, cependant une cuve respectant les conditions suivantes : largeur > 0,4 x longueur et largeur > 1,1 x hauteur, devrait convenir.
2.5. Traitements de l’eau
Les invertébrés récifaux, quels qu’ils soient, nécessitent une eau de qualité… récifale. La résistance des Octocoralliaires, plus ou moins grande aux dérives, ne dispense pas de mettre en œuvre, comme pour les SPS ou les LPS, les principes habituels de l’aquariophilie récifale. Les exigences seront plus sévères pour les espèces vivant dans les eaux oligotrophes et oxygénées portées par les courants du large et pour les espèces azooxanthellées. Ils sont sensibles à l'évolution de la qualité chimique et biologique de l'eau, vecteur d’infections bactériennes et de prolifération des algues. La charge de nourriture doit être compensée par des moyens de traitement performants et une bonne oxygénation de l’eau, au risque de voir dériver rapidement les paramètres.
Il faut retenir cependant que tout traitement ne devra pas, autant que possible, nuire au nourrissage des espèces azooxanthellées, en laissant les éléments nutritifs, librement disponibles dans l’eau, le temps nécessaire. Les traitements doivent aussi épargner les matières organiques dissoutes, assimilables par les invertébrés, produites naturellement dans l'aquarium. Particulièrement pour les espèces azooxanthellées, il convient de trouver le juste équilibre entre épuration de l’eau et conservation des nutriments. En présence de ces derniers, certains traitements pourront être intermittents.
2.5.1. Filtration mécanique
Un bon nombre des invertébrés concernés possèdent des tissus sensibles aux blessures, aux recouvrements par les sédiments et aux infections. D’autres, comme les gorgones de la famille Acanthogorgiidae, branchues et dont les polypes sont pourvus de nombreux sclérites proéminents, accrochent les algues en suspension. Plus qu’ailleurs, dans un circuit fermé où ces corps étrangers ne manqueront pas d’entrer en contact avec les animaux, il est indispensable de mettre en place un système de filtration mécanique évacuant au plus tôt du système, toutes les macro-particules.
Les espèces massives d’Octocoralliaires Sarcophyton, Sinularia, Lobophytum sont bien souvent les premières acquisitions de l’aquariophile. Ce dernier, confiant dans sa belle réussite, introduit ensuite des SPS. Les chimiorécepteurs des occupants en place détectent vite les intrus, une guerre chimique se déclare. Les toxines secrétées en quantité sont d’autant plus virulentes qu’elles agissent dans un espace clos. Les durs Scléractiniaires ne résistent pas longtemps aux attaques à distance et dépérissent. C'est une des raisons à l’origine de la croyance que la maintenance des Scléractiniaires serait plus difficile que celle des Octocoralliaires. Il n’en est rien, des espaces suffisants associés à des processus de traitement adaptés assurent une bonne cohabitation.
Selon l’installation, un filet, un filtre sur ouate, externe ou dans la cuve technique… peut convenir. La maille du filet ou la porosité de ce filtre doit être suffisamment grande pour ne pas retenir les microparticules de nourriture planctonique distribuées aux espèces non photosynthétiques ou bien il sera désactivé durant les longues et fréquentes périodes de nourrissage.
2.5.2. Adsorption sur charbon
Les Octocoralliaires produisent, parfois en grande quantité, des métabolites secondaires dont certains sont toxiques. Ces substances chimiques atteignent tous les habitants du bac, invertébrés et vertébrés, qui leur résistent plus ou moins bien et plus ou moins longtemps. Les espèces massives comme Sarcophyton, Sinularia, Lobophytum… dégagent le plus de substances. Ces réactions chimiques ont lieu à tous niveaux et les Octocoralliaires sensibles tels que certaines gorgones et Alcyonaires non photosynthétiques peuvent subir un stress au point de ne plus s’alimenter.
Ces substances biochimiques imposent d'utiliser du charbon activé, sans phosphate, pour adsorber quelques molécules toxiques qui ne le seraient pas autrement. Ce dernier est utilisé en mode passif, dans une poche de filtration, dans l’écoulement de l’eau de la cuve technique ou traversant un lit fluidisé, selon la biomasse de coraux concernés.
2.5.3. Épuration biologique (PV, sable, RAB et ATS)
D’une manière générale, les principes qui prévalent pour les scléractiniaires sont valables pour les Octocoralliaires. Les méthodes éprouvées, basée sur la bio filtration par les éléments du décor, telles que la méthode Berlinoise et celles qui reposent sur l’utilisation de lits de sable épais (Jaubert, DSB…) sont valables pour tous les Octocoralliaires.
Les supports bactériens peuvent être constitués de pierres et de sable vivants en proportions adaptées à la méthode choisie. D’autres matériaux (zéolithes, charbons, biopellets…) utilisés au sein de réacteurs à bactéries (RAB) à lits fluidisés ou pas, avec adjonction de sources de carbone adaptées au système, peuvent être exploités pour maintenir les taux de nitrates et de phosphates acceptables.
Réacteur à bactéries

Le RAB, garni d'un support bactérien (charbon, biopellets...), peut avoir deux objectifs distincts :
- entretenir une colonie bactérienne en mesure de consommer phosphore et azote pour maintenir des taux de PO4 et NO3 satisfaisants dans l'aquarium ;
- produire un bactérioplancton en quantité, destiné à l'alimentation des invertébrés bactério-planctonivores.
Dans le cas d'utilisation de charbon, la chambre de réaction est garnie d'un charbon actif, garanti sans PO4, peu abrasif et de faible densité, suffisamment pour être mis en très légère suspension. Le volume de charbon d'environ 1 litre pour 1000 litres d'eau, occupe à peu près 1/3 de la hauteur de la chambre de réaction. Il est traversé de bas en haut par l'eau de l'aquarium. Le débit de l'eau est ajusté, au moyen d'une vanne, de telle sorte que le temps de contact avec le charbon soit d'au minimum 20 secondes. La sortie du RAB est orientée vers l'entrée de l'écumeur dans le premier objectif ou vers les spécimens à nourrir dans le second.
Le RAB est éventuellement ensemencé en bactéries régulièrement (au moins 3 fois par jour) alimentées en carbone. L'évolution du dosage de carbone doit être progressive, dans les 5 jours suivant le démarrage du RAB et ceux précédant son arrêt. Le dosage est ajusté selon l'évolution des paramètres NO3 et PO4 du bac. Les sources de C peuvent être variées (alcool : éthanol, méthanol ; sucre : glucose, saccharose ; acide carboxylique : acide acétique ; acides aminés...).
Une composition empirique type "Méthode VSV" (200 ml de Vodka à 40°, 20 g de sucre blanc et 50 ml de vinaigre à 7°) peut être utilisée comme base de départ. Débuter avec un dosage léger de 0,1 millilitres pour 100 litres par jour. Énergétiquement, 5 g de sucre valent 100 ml de vinaigre à 7° et 7.5 ml de vodka 40°. Le dosage de C ne doit jamais dépasser 1 gramme pour 1000 litres et par jour, c'est à dire environ 0.5 millilitres de vodka ou VSV pour 100 litres par jour. Le taux final, de même que le ratio entre les différentes sources de carbone, peuvent être ajustés selon les performances mesurées sur les NO3 ou PO4 et les effets visuels dans le bac (cyanobactéries, mulm bactériens...). Pour atteindre un faible taux de PO4, l'apport énergétique par le sucre est parfois renforcé dans certaines formules VSV, jusqu'à 50 g de sucre, en surveillant le développement des films et amas bactériens sur les vitres et supports.
De la même manière, les filtre à algues (Algae Turf Scrubber : ATS et ses dérivés) sont en mesure d’éliminer une partie des nitrates et phosphates, s’ils sont bien gérés.
2.5.4. Écumage
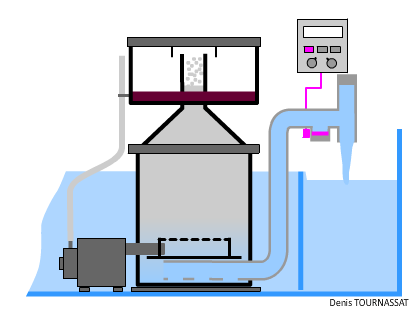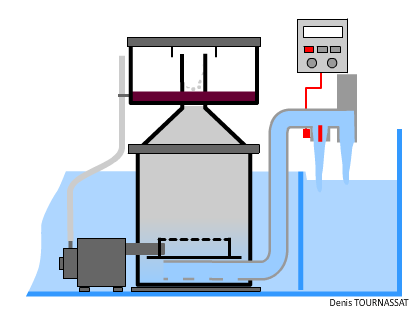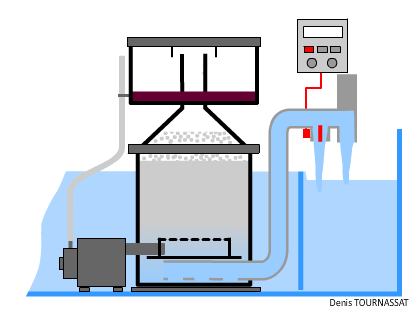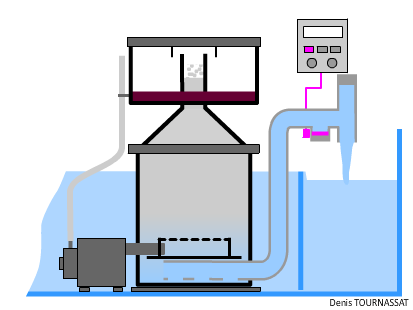
L’écumeur est un élément pratiquement incontournable, il est en mesure d’éliminer un certain nombre de molécules. Suffisamment réactif, il permet de traiter rapidement une pollution soudaine, notamment quand on souhaite nourrir les suspensivores en quantité. Il doit être dimensionné comme il se doit dans tout système récifal, en relation avec les autres types de traitements et la faune détritivore présente.
On lit souvent que l’écumage doit être plus performant avec des systèmes hébergeant des organismes NPS nourris abondamment. Cette idée résulte d'une habitude consistant à nourrir beaucoup, de temps en temps, pour atteindre les polypes des invertébrés. L’amélioration des nourritures, des techniques et l’automatisation permettent de nourrir tout autant mais de manière très régulière sans polluer plus qu’un aquarium hébergeant des coraux zooxanthellés.
Un écumeur peut-il être trop performant ? Sa capacité à oxygéner l’eau est un atout indéniable. L’écumage, en mesure d'extraire des substances colloïdales mais aussi certaines particules nutritives en suspension dans l'eau, devrait pourtant cesser durant les périodes de nourrissage des organismes NPS. Plutôt que d’arrêter la pompe de l’écumeur, on peut la laisser produire normalement le mélange air/eau. Il suffit alors d’augmenter le débit de sortie, et ainsi de baisser le niveau dans la chambre de réaction. Ceci peut s’obtenir en augmentant, automatiquement ou non, la section de sortie, éventuellement en ouvrant une vanne. De cette manière l’eau aérée continue à circuler.
2.5.5. Changements d’eau
Selon la charge de nourriture dont les effets sont mesurés par les tests nitrates et phosphates, les changements pourront, dans les cas extrêmes, être importants et atteindre 50 % hebdomadaire. Des distributions de nourritures adaptées, régulières et mieux distribuées au fil de la journée permettent cependant d’abaisser les niveaux de pollution. Ainsi, normalement un aquarium d’Octocoralliaire ne nécessite pas plus de précautions qu’un autre de Scléractiniaires. Les changements d’eau restent un moyen d’apporter des oligoéléments, dans la mesure où ils ne sont pas fournis par ailleurs.
La concentration d’oligoéléments résultant de ces apports reste une inconnue, du fait de la méconnaissance de la nature et de la concentration des produits incorporés, ou simplement par ce que l’on ne mesure pas la consommation réelle des habitants. Un reset de l’eau, par exemple annuel, est donc toujours souhaitable avec une eau dont la composition se rapproche le plus de l’eau de mer naturelle.
2.5.6. UV et ozone
Les traitements par UV ou ozone contribuent à l’extraction des déchets non éliminés par l'écumeur. Ces dispositifs permettent de conserver une eau limpide et d’éliminer les toxines présentes dans l'eau.
La lampe à UV doit être adaptée (ex : 39 Watt pour un aquarium de 500 litres). On conseille d’installer le stérilisateur UV dans la cuve technique, en amont de l'écumeur.
Quelques aquariophiles ont pu noter des effets positifs sur l'extension des polypes d’espèces de NPS réputées difficiles comme Dendrophyllia et Dendronephthya, avec des injections d’ozone. Quels bénéfices peuvent tirer des espèces non photosynthétiques d'une eau plus claire ? Est-ce le résultat d'une diminution des agents pathogènes ? Nous disposons de peu d’informations et sur une durée trop courte pour juger de son efficacité à long terme. L'ozone serait alors injecté directement dans l’écumeur, les injections étant pilotées par un redox mètre.
2.5.7. Autres traitements, supplémentations
Supplémentations : les Octocoralliaires ne sont pas des coraux constructeurs de récifs, mais les réactions de calcification pour la production des sclérites doivent être entretenues par des apports de minéraux et d’oligoéléments. Les besoins en calcium, magnésium, carbonates etc. sont moins importants que ceux des coraux hermatypiques, ils pourront être réalisés par les changements d’eau pour les aquariums de petits volumes dédiés aux octocoralliaires ou par les méthodes de supplémentations usuelles pour les scléractiniaires (Balling, réacteur à hydroxyde de calcium ou réacteur à calcaire), la taille des réacteurs étant toutefois plus restreinte.
Anti PO4 : les réactions de calcification ne doivent pas être inhibées. Il semble que ces coraux supportent des doses au-delà de 1 mg/l de PO4. L’emploi de traitement antiphosphate n’est pas une nécessité, sauf si l’aquarium héberge des espèces plus sensibles. La présence d'algues en excès sur les tissus, qu'elle résulte d'un éclairement trop important comme on l'a vu plus haut ou d'un taux de nutriments élevé, n'est pas souhaitable. On peut alors utiliser, dans un réacteur à lit fluidisé ou en passif, des produits adsorbant les phosphates à base de fer ou d’aluminium, ou bien des produits floculant les PO4 éliminés par l’écumeur.
Oligoéléments : les avis sur la nécessité d’ajout d'oligoéléments en milieu clos, sont toujours partagés. Il est toutefois admis que certains Octocoralliaires assimilent de l'iode ainsi que du fer. Des auteurs expliquent d'ailleurs le dépérissement rapide de certaines espèces (Xenia...) par des carences en oligoéléments. L'iode par exemple, a une action bénéfique contre les bactéries et semble-t-il contre des protozoaires pathogènes. Pourtant, un aquarium exclusivement composé d'Octocoralliaires dont la biomasse n'est pas négligeable, est plus exposé à une carence en iode lequel est habituellement introduit via la nourriture proposée aux poissons. Il peut donc être judicieux d'en introduire, mais sans excès étant donnée leur potentielle toxicité en surdose.
2.5.8. Système DyMiCo
DyMiCo (Contrôle dynamique minéral) est un système de filtration qui permet, de traiter l'eau d'un milieu clos, tel qu'un aquarium, de manière naturelle, sans filtration mécanique, tout en préservant le plancton et les larves qui s'y développent. Utilisé avec succès dans des aquariums publics, ce système automatisé, basé sur des processus biologiques, est tout à fait indiqué pour maintenir les invertébrés planctophages. De rares témoignages, qui mériteraient d'être étayés, tentent de démontrer que ce système aurait permis de maintenir et d'assurer la croissance d'Octocoralliaires et d'autres invertébrés azooxanthellés jusque-là réputés impossibles à tenir.
2.5.9. Automatisation
Comme pour tout système de maintenance récifale, certains processus comme l’éclairage, l’osmolation, le brassage… seront automatisés. D’autres resteront à l’appréciation de l’aquariophile.
Le nourrissage des espèces azooxanthellées est un paramètre critique qui mérite toute la rigueur possible. Plus vitale que pour d’autres, et sauf pour les espèces qu’il aura choisi de nourrir individuellement, le soigneur ne peut se baser éternellement sur sa bonne volonté pour assurer les distributions : elle faillira un jour. Quelle que soit la forme de la nourriture prévue (vivante, congelée, sèche, liquide…), il est impératif d’assurer, autant que possible, les distributions régulièrement et de préférence automatiquement. La programmation est bien sûr, paramétrée en fonction des autres fonctions (allumage et extinction de la lumière, filtrations, changements d’eau, écumage…). S’agissant plus particulièrement du nourrissage d’espèces azooxanthellées, les dispositifs tels que les pompes doseuses ou ordinateur doivent être de qualité et fiables dans la durée.
3. Nourriture
Ce chapitre concerne tous les Octocoralliaires, mais on l’a bien compris, il est de première importance avec les espèces azooxanthellées. Disposant pour ces dernières, de peu d’informations sur l’efficacité de la nourriture et du nourrissage sur le long terme, les lignes qui suivent sont le reflet de pratiques, de témoignages, ou même de simples suggestions, de la part d’amateurs ou de professionnels. Elles sont reprises ici afin de ne pas en éliminer d’emblée. Elles doivent être interprétées avec les réserves qui s’imposent.
À la lecture d’Octocoralliaires 2 - Biologie : nutrition, reproduction, on s’aperçoit que ces invertébrés consomment, selon les espèces, plusieurs types de planctons, des particules vivantes ou inertes de tailles variées et des matières organiques en solution ou non. La nourriture apporte l’énergie nécessaire pour réaliser tous les métabolismes du corail (croissance, reproduction, protections, pigmentation…), mais on est loin d’avoir déterminé l’impact de chaque composant nutritionnel sur les différentes fonctions biologiques, aussi la nourriture doit être la plus variée possible, dans le champ de ce que l’animal accepte.
3.1. Nourritures vivantes
La raison conduit à proposer aux Octocoralliaires, surtout aux espèces difficiles NPS, une nourriture proche de celle du milieu naturel : bien souvent vivante. Ils se nourrissent essentiellement de phytoplancton et pour certains, d'une part de zooplancton et/ou de bactérioplancton dont la proportion, difficile à mesurer, peut varier d'une espèce à l'autre. La taille des particules doit bien évidemment être proportionnée avec celle du tube digestif et correspondre également à l’espacement des pinnules, afin de déclencher l’érection du polype. La taille visée va du plus petit jusqu’à environ 300 µm pour quelques espèces.

3.1.1. Phytoplancton
Parmi les nombreuses espèces constituant le phytoplancton marin, quelques-unes ont été identifiées dans les chambre gastriques des polypes : des protistes pélagiques autotrophes Dinophyta (Dinoflagellés), des microalgues Bacillariophyta (diatomées) telles que Chaetoceros et d'autres comme Nannochloropsis, Isochrysis et Tetraselmis spp. Quelques réussites au Long Beach aquarium of the Pacific ont été observées sur Dendronephthya sp. avec Chlorella sp., Spirulina sp., Isochrysis sp., et Nanochloropsis sp. Leur taille est pour l’essentiel inférieure à 20 µm.
Les algues planctoniques marines contiennent des acides gras polyinsaturés oméga-3 (EPA, DHA et ARA) et omega-6 essentiels à la santé des coraux, que ces derniers ne peuvent fabriquer. La composition des différentes algues varie en nature et teneur en acides gras (par exemple Chlorella ne contient pas d’EPA ni DHA), il est donc important de mélanger les espèces. Celles disponibles sur le marché sont malheureusement peu nombreuses.
Les diatomées qui prolifèrent sur les vitres éclairées sont une source facile, mais leur quantité sera insuffisante, notamment dans des aquariums peu éclairés hébergeant des espèces non photosynthétiques. On peut se lancer dans l’élevage de Nannochloropsis oculata, Isochyrsis galbana, Tetraselmis sp. Les souches peuvent se trouver dans le commerce ou auprès d’amateurs avertis. L’article d’Olivier Soulat Phytoplancton et zooplancton, les indispensables pour l'élevage expose en détail les protocoles d’élevage de ces nourritures planctoniques. L'élevage personnel présente l'avantage de maitriser le moment de prélèvement, de préférence à la fin de la phase de croissance exponentielle quand il est le plus riche. Il permet également de connaitre exactement les conditions de culture (le milieu de Conway, équilibré et adapté à la culture de tout type d’algue ne présente pas de risque ; a contrario, l'utilisation d'engrais induit l'introduction, dans l'aquarium, d'éléments non désirables tels que nitrites, phosphate, métaux lourds...).
L’élevage présente quelques contraintes de disponibilité, d’espace et de contaminations. On peut alors acheter du plancton, vivant (tableau 2). Le fournisseur communique rarement les informations précieuses ci-dessus, ce qui le rend moins attrayant, mais il présente l’avantage de disposer de plus d’espèces, immédiatement disponibles au moment voulu. Le phytoplancton vivant se conserve quelques semaines au réfrigérateur.
3.1.2. Zooplancton
La taille visée n’excédera pas 200 à 300 µm, cette taille maximale ne pourra être acceptée que par les espèces à gros polypes. Le plus simple consiste à héberger dans le système une faune de nature à fournir des larves acceptables :
- L’idée vient naturellement de laisser proliférer (dans un décor protégé à l’intérieur de l’aquarium ou dans un refuge à l’abri de prédateurs) une microfaune (Amphipodes…), mais ses larves seront majoritairement benthiques, elles ne présentent pas d’intérêt véritable pour des organismes filtreurs. Les larves de copépodes pélagiques tels que celles de l'ordre des Calanoïdes dans leur dernier stade de développement (le stade « copépodite » qui suit le stade « nauplius »), sont plus appropriées.
- Les crevettes (Lysmata amboinensis, L. debellius…) libèrent régulièrement des œufs dont les larves (zoé) pourront, à condition qu’elles soient en nombre suffisant, améliorer l’ordinaire de certaines espèces partiellement zoo planctophages.
- Certains invertébrés marins, comme les mollusques bivalves (palourdes, huîtres, pétoncles, moules…), essaiment des œufs dont les premières formes larvaires (larves trochophores) sont libres, très nutritives et mesurent en moyenne 50 µm. Le nombre de trochophores produit lors d’une ponte d’huitre de culture est très important, de l’ordre de quatre milliard ! Cette ponte est relativement facile à déclencher avec un léger choc thermique ou chimique. De très rares commerçants proposent des jeunes larves trochophores d'huîtres et de palourdes cryogénisées (Trochofeed de Cryofeeds Ltd., Canada). Ceci permet de disposer à tout moment de larves ciliées vivantes, âgées d’une quinzaine d’heures, encore pélagiques et sans coquille. À l’instar des rotifères, la nage des trochophores est lente et saccadée donc tout à fait compatible avec la mauvaise prédation de nos suspensivores.
Ces invertébrés ont toute leur place dans un aquarium d’animaux filtreurs. Mais qui souhaite baser totalement la nutrition sur ces espèces, devra envisager de les élever avec nécessité, pour les nourrir, de monter un élevage de phytoplancton en amont.
On peut envisager l’élevage de rotifères (Brachionus plicatilis …) dont la taille moyenne se situe autour de 200 µm ou celui de copépodes Calanoïdes (Acartia sp.) dont la taille, aux stades nauplii et copépodites, s’échelonne de 70 à environ 200 µm. Toutefois ces organismes, particulièrement les rotifères, nécessitent d’être enrichis, notamment en acide gras, soit par l’intermédiaire d’un mélange de phytoplancton soit par de la nourriture spécifique (huile de poisson...). Quelques enseignes commercialisent des souches de copépodes (tableau 2). L’article d’Olivier Soulat, cité ci-dessus, définit le protocole de leur élevage. On trouvera sur le net de nombreux protocoles d’élevages de crevettes ainsi que des descriptifs détaillés et éprouvés de production de bivalves, pour l’aquaculture.
3.1.3. Bactérioplancton
Les algues marines sécrètent un mucus (mucilage) issu de l’action bactérienne avec des matières organiques dissoutes. Ce biofilm superficiel, riche en éléments organiques, dont des bactéries, constitue une source alimentaire pour les coraux. Dès lors, il est tentant d’exploiter leurs propriétés nutritives (en même temps, que leur capacité à absorber nitrates et phosphates). Certains aquariophiles équipent donc leur installation de filtre à algue (Algae Turf Scrubber ou ATS et ses dérivés) et procèdent à une sorte d’essorage en vue d’en extraire les biofilms.
Dans le même esprit, quelques récifalistes ont eu l’idée de faire circuler l’eau sur des éponges qu’ils pressent quotidiennement dans l’eau afin de laisser s'échapper la flore bactérienne qui a pu s'y développer en surface. Un réacteur à bactérie (avec charbon, zéolithe…) peut obtenir le même effet avec la possibilité d’automatiser l’opération, comme on va le voir plus loin.
| Nourritures | Références |
|---|---|
| Phytoplancton | PlanktoMarine Live (Grotech) ; (JBS Marines) ; Shellfish Diet 1800 (Reed Mariculture inc.) : concentré à 8 % d'Isochrysis, Pavlova, Tetraselmis et Thalassiosira pseudonana. |
| Zooplancton |
Copépodes : (Europrix) ; (JBS Marines) ; Tigger-Pods (Reef nutrition) Rotifères :(Europrix) ; (JBS Marines) |
| Bactéries | Bactoreef (Daphbio) ; Zeoback (Koralen-zucht) ; Ultra Bio (Fauna marin)… |
3.2. Nourritures de substitution
Dans l’impossibilité de conduire des élevages de phyto ou zooplancton (micro-détritivores, crevettes…) ou d’acquérir des bivalves tropicaux, on peut se rabattre sur des nourritures de substitution proposées en magasins. Il s’agit de nourritures présentées sous formes liquides, congelées ou lyophilisées. Le plancton mort contient une portion de particules décomposées et n’offre malheureusement pas tous les bénéfices du plancton vivant, aussi le marché propose quelques compléments alimentaires de nature à compenser ses lacunes.
3.2.1. Compléments alimentaires
On trouve dans le commerce quelques compositions complexes (tableau 3), difficile à classer, destinées aux invertébrés filtreurs et dont les effets sur le nourrissage sont parfois notables. Il s’agit de matières organiques dissoutes ou micro particulaires, présentés en principe sous forme liquide (acides aminés (AA), acides gras hautement insaturés (HUFA), vitamines, oligoéléments), de gels hébergeant une faune bactérienne, parfois associée à du plancton ou de produits fermentés….Ces ingrédients ont des fonctions plus ou moins clairement définies et parfois complémentaires : énergétiques, appétants stimulant le gonflement des polypes et le déploiement des tentacules, croissance, coloration... complétés d’autres composants aux fonctions tenues secrètes.
Les produits appétants (AA…) sont à distribuer environ une demi-heure avant la nourriture. Le dosage doit être préalablement défini en fonction de la population et du système en place, si l’on ne souhaite pas une dérive de la pollution.
| Type | Références |
|---|---|
| Complexes enrichissants | Ultraback : AA, vitamines, Ultramin : AA, vitamines, UltraMin S : AA, vitamines, oligoéléments, Ultramin D : AA, Ultra Food Energizer : huiles, vitamines, extraits d’algues, AA, ail… de Fauna marin ; Aminos de Purety ; KZ Amino Acid et Pohl's Coral Vitalizerde Korallen-zucht ; Selco boots d'Aqua-Tech Co : complexe d’ AA, W 3, AG, vitamines ; Fuel d'Aquavitro : glucides, vitamines, AA, AG, oligo-éléments ; Microplan de Preis ; AlgaMac-Enhance d'Aquafauna Bio-Marine : algues Schizochytrium, Haematococcu et additifs (enrichissement zooplancton)… |
| Neige marine | Marine snow de TwoLittleFishies : particules de20 à 150µm amalgamées en flocons colloidaux ; Pro-Coral reef Snow de Tropic Marin ; Ultrapac de Fauna Marin : gel polymère liant les nourritures ; CoralSnow de Korallen-zucht… |
| Préparations micro-particulaires | Mixture très fine d’huitres, moules, coques et gambas fraiches, en nombre égal et avec leur eau et congelé de type « Papone ». (Attention : la mixture Papone est parfois fermentée plusieurs heures à la chaleur ; une fermentation mal conduite peut engendrer l’apparition de bactéries pathogènes). |
| Préparations liquides | Expansion des polypes : jus de calamar ; jus de bivalves. |
3.2.2. Nourritures
Plusieurs critères conduisent à sélectionner les nourritures :
3.2.2.1. État de la nourriture
- Congelé ou surgelé : les nourritures conservent leurs propriétés originelles plusieurs mois en congélateur.
- Frais : les produits se rapprochent de leur qualité d’origine, à condition que la chaine du froid soit respectée en amont et qu’ils soient conservés au réfrigérateur. La durée de conservation est en général limitée à un mois.
- Lyophilisé : les nourritures sèches conservent une partie de leurs propriétés. Elles peuvent être stockées au-delà d’un an et sont donc plus facilement disponibles. Selon la taille des particules, elles devront être broyées et systématiquement imbibées d’eau salée ou imprégnées de compléments liquides avant distribution.
3.2.2.2. Flottabilité


La nourriture doit se présenter plusieurs fois dans l’environnement d’un animal filtreur avant d’être captée. Les particules de nourriture doivent donc rester le plus longtemps possible en suspension dans l’eau. Les produits proposés sont de ce point de vue, très variables. Il en est qui tombent très vite sur le fond, d’autres qui remontent rapidement vers la surface et enfin d’autres dont la majeure partie reste en sustentation plusieurs dizaines de minutes. Pour ce, on évitera les formules imprégnées d’huile comme certaines préparations lyophilisées d’œufs de cyclops qui ont une fâcheuse tendance à flotter en surface ainsi que celles, trop denses, qui se dirigent trop vite vers le fond.
3.2.2.3. Pouvoir nutritionnel et taille
Ce sont bien là les paramètres essentiels qui ne valent pourtant rien si le produit est défectueux ou s’il n’arrive pas jusqu’au polype. Afin de bénéficier au plus grand nombre d’invertébrés filtreurs, la taille des nourritures doit s’approcher de celles à l'état sauvage. L’offre reste encore pauvre et ne couvre pas la plage disponible sur le récif mais les recherches in situ relayées par quelques fabricants laissent entrevoir que, d’ici quelques années, nous pourrons disposer de produits plus variés en qualité et taille, avec l’espoir de maintenir des espèces aujourd’hui réputées impossibles. Les informations sont encore timides, ce qui ne facilite pas la tâche des amateurs. On privilégiera les fabricants les plus transparents, ceux qui, sans rentrer dans le détail de leurs secrets, définissent avec le plus d’exactitudes leur produit : le contenu énergétique, la taille des particules et la nature des composants. Ce n’est qu’ainsi que nous pourrons progresser dans la maitrise de l’alimentation des espèces exigeantes.
3.2.3. Produits
Les bacs d’Octocoralliaires contiennent en général des espèces aux besoins différents, sans compter les autres types d’invertébrés filtreurs qui cohabitent avec eux. Les préparations doivent répondre aux besoins de chaque espèce aussi, il faut parfois se renseigner sur celles qui sont appropriées. Quelques sociétés s’intéressent de près aux invertébrés filtreurs et proposent une gamme ciblée (Fauna marin, Reef nutrition..). Cependant, les notices manquent encore de clarté que ce soit dans la composition, les tailles de particules ou les objectifs visés. Le marché propose une quantité importante de références. Le tableau 4 qui suit, non exhaustif, propose quelques nourritures destinées aux filtreurs, parmi les moins obscures, disponibles sur le marché. Les fiches techniques n’étant pas toujours très compréhensibles nous invitons les fabricants à signaler les éventuelles erreurs.
| Nourritures | Références |
|---|---|
| Phyto plancton |
Liquide : Phyto Feast de Reef Nutrition : Isochrysis, Tetraselmis, Pavlova, Nannochloropsis, Thalassiosira, Synechococcus et vitamines ; Lyophilisé : Ultra Clam de Fauna Marin ; Planctomarine P de Grotech ; Reef phytoplancton de Seachem… |
| Zooplancton |
Pro coral zooton de Tropic marin : mix. zooplancton, spiruline levure ; ZooPlan d’Aquarium Systems ; Reef zooplancton de Seachem, Ultra Seafan de Fauna Marin, particules protéinées ; Ultramin F de Fauna Marin ; Coral Vitalizer de Preis ; Reef Roids de Poly Lab : planctons marins 150-200µm, enrichis ; Rotifères : Roti Feast de Reef Nutrition Œufs de bivalves : oeufs de crevettes stade mysis ; Œuf d’huitre : Oyster-Feast de Reef Nutrition Cyclops : Cyclop-eeze de Laboratoire Argent. |
| Microparticules variées |
Reef Pearls de Reef Interests : ingrédients encapsulés à tailles calibrées : 5 à 200 ;;5 à 100 ; 100 à 300 et 300 à 800 µm ; Nutri Marine Instant de Grotech : Poissons, huiles, graisses, céréales, levures ; Coral V powder de Preis : AA, acides gras Oméga-3, Cyclop-Eeze minéraux, oligo-éléments. Particules de bivalves type Papone, micro-broyées ; Nourritures pour alevins micro-broyées. |
| Agents liants, biopolymères | Reef snow de Tropic Marin, Ultra Pac de Fauna Marin, Reef Snow de Brightwell Aquatics. |
3.2.4. Préparations de nourritures de substitution
On trouve de nombreuses recettes personnelles, certaines sensées d’autres plus excentriques mélangeant des produits similaires, des tailles inadaptées sans omettre d’y rajouter des compositions commerciales totalement occultes. De nombreux récifalistes partent du principe que "plus il y en, mieux c’est" et "ce qui n’est pas capturé par les uns sera mangé par les autres". Ces approches fatalistes peuvent réussir mais laissent peu de place à la réflexion nécessaire pour améliorer la maitrise de notre maintenance. Ne devrions-nous pas définir le but avant les moyens pour mieux tenter d’en suivre l’efficacité ?
L’idée qui prédomine aujourd’hui pour les espèces les plus exigeantes est de fournir :
- Un produit appétant avant distribution ;
- La nourriture planctonique, variée, fraiche ou sèche, de taille adaptée à chaque type de corail. Le rapport phyto/zoo varie de 100/0 à 50/50 selon les espèces.
- Des compléments alimentaires destinés à compenser les carences des nourritures de substitution.
- la nourriture fraîche est distribuées à part.
- la nourriture sèche est préalablement imprégnée de complément liquide suivant le protocole décrit plus loin, avant d’être diluée dans de l’eau salée puis distribuée. - Éventuellement des apports bactériens, selon les espèces.
- Éventuellement un liant biopolymère (qui peut être à base d'extraits d'algues), permettant d'amalgamer les planctons et compléments alimentaires, en particules flottantes dont la taille peut être ajustée selon le besoin des animaux.
La présentation des produits dans les tableaux ci-dessus, permettra d’orienter ses propres choix. Une meilleure définition des spécialités commercialisées devrait aussi permettr,e dans l’avenir, d’éviter les composants redondants. Soulignons la démarche exposée par Fauna Marin dans son guide Bedienungsanleitung zum Sea Fan und Dendro System (traduction française, sans engagement : Manuel Sea Fan System et Dendro System). Ce dernier suggère quelques recettes simples en fonction des types de filtreurs.
4. Nourrissage
4.1. Nourriture
La taille du phytoplancton utilisé varie de 1 à 20 µm mais, difficile à mesurer avec exactitude, elle souffre d’incertitudes qui peuvent engendrer des écarts : une faible augmentation de diamètre de 10 % peut induit une forte augmentation de biomasse de plus de 30 %. Le besoin énergétique du corail étant lié à la biomasse de nourriture, certains fournisseurs de phytoplancton indiquent, à juste raison, son extrait sec en % de la masse. Les petites quantités employées sont plus difficile à peser avec précision. Le récifaliste soucieux de suivre la valeur énergétique de sa préparation, devra donc établir une corrélation avec le volume de poudre non tassé (masse volumique apparente). La mesure sera plus facile avec des cuillères doseuses, exprimées en millilitres, la poudre étant arasée sur leur bord supérieur.
Le tableau suivant présente à titre indicatif deux recettes de base, inspirées de l’expérience d’amateurs sur le net. Il faut le reconnaitre, le manque de recul nous impose la prudence et il faudra surement les reconsidérer ou les affiner avec nos connaissances. La nature et la taille du plancton étant variées, il peut être nécessaire de les adapter aux espèces hébergées en fonction de leurs besoins spécifiques.
| Élément | Octocoralliaires zoox. Gorgones azoox. à gros polypes | Octocoralliaires azoox.à petits polypes (Dendronephthya…) | Dosages |
|---|---|---|---|
| Phytoplancton sec (espèces variées) |
50 à 75 % | 100% | 5 ml / 500 l / jour |
| Zooplancton sec < 200 µm (rotifères et autres) |
25 à 50 % | - | |
| Compléments énergétiques (AA, vitamines…) |
Possible | oui | 3 à 5 ml / 1000 l / jour |
| Bactéries | - | oui | 0.1 ml (2 gouttes) / 100 l 2 fois par semaine. |
| Biopolymère | Possible | Efficacité à confirmer | Selon préconisation et taille finale souhaitée (voir ci-dessous) |
Le Manuel Sea Fan System et Dendro System de Fauna Marin donne également quelques informations complémentaires utiles sur le nourrissage des azooxanthellés.
4.2. Préparation des recettes de plancton
Un intérêt des microplanctons réside dans la finesse de leur particules que l’on doit préserver jusqu’à l’assimilation par l’animal. Ceci ne pose pas de problème quand il s’agit de plancton acquis sous forme liquide, il en va autrement lorsqu’on manipule du plancton en blocs congelés ou lyophilisé. Les cubes congelés se dissolvent en conservant des agglomérats ; répandu sous forme de poudre sèche, il flotte en surface.
Pour assurer une bonne dispersion et s’approcher d’une flottabilité nulle, on pourra préparer le plancton sec :
Suivant la méthode préconisée par Fauna marin :
- Doser et mélanger les planctons secs dans le ratio souhaité.
- Imprégner le plancton de liquide pour obtenir un miel visqueux et homogène. Plutôt que d’utiliser de l’eau de mer, il est préférable d’utiliser les compléments liquides prévus (acides aminés… et éventuellement des gouttes de bactéries) qui seront ainsi mieux assimilés par le polype.
- Une fois la consistance obtenue, rajouter un film de liquide superficiel d’épaisseur 1 à 2 mm.
- Laisser reposer quelques heures au réfrigérateur, le film superficiel est absorbé et la mixture gonfle.
- Remuer pour homogénéiser.
- Délayer, progressivement au début, avec de l’eau de l’aquarium (pas d’eau douce), jusqu’à rendre le mélange fluide, à la concentration souhaité. À ce stade, on peut mouler quelques cubes de glaçons pré-dosés conservés plusieurs mois au congélateur.
- Avant utilisation, diluer le mélange ou les cubes congelés dans la quantité d’eau à distribuer dans l’aquarium, pour une période et un volume donnés.
Ou celle proposée par Tropic marin:
- Préparer un liquide gélatineux à base de biopolymère Coral snow dilué dans de l'eau osmosée à raison de 1 à 2 doses dans 100 ml. La concentration détermine la taille des agrégats finaux. Laisser reposer deux heures. Le liquide peut être conservé 15 jours à température ambiante.
- Incorporer les planctons lyophilisés et autrs additifs pré-dosés et laissre gonfler une trentaine de minutes.
- Distribuer la neige de nourriture ainsi formée au rythme souhaité.
Les préparations se conservent un à deux jours à température ambiante selon la saison, une semaine au réfrigérateur et plusieurs mois au congélateur.






4.3. Concentration de la nourriture distribuée

On imagine facilement que la concentration en nourriture influe sur l’alimentation d’un animal. C’est vrai pour les coraux, c’est particulièrement vrai pour les coraux azooxanthellés dont les sources d’énergie sont plus limitées, et c’est encore plus vrai pour les animaux sessiles qui ne peuvent se déplacer vers les sources nutritionnelles.
Les concentrations élevées de particules alimentaires dans la colonne d’eau (MOP, proies…) améliorent les chances de rencontre entre l’aliment et le moyen de capture de l’animal (polype, mucus…), et donc favorisent l’alimentation. Il existe pourtant une relation entre le taux alimentation de l’animal et la densité des particules alimentaires. Elle est linéaire jusqu’à un certain niveau : au-delà d’un seuil de concentration, les organes de capture ne peuvent plus capturer, ingérer et digérer. Cette situation se traduit de manière temporaire par le rejet de particules alimentaires, la fermeture de polypes ou le dégonflement des tissus. La quantité de nourriture à délivrer dépend donc du volume d’eau. La densité de particules doit, de plus, être maintenue au fur et à mesure de la consommation par les filtreurs hébergés. Ce renouvellement n’est pas négligeable en présence d’autres suspensivores microphages tels que les bivalves, tuniciers et éponges ou les vers polychètes qui occupent le fond si on a choisi l’option d’un fond sableux.
| Type plancton | Dens. |
|---|---|
| Virioplancton ≈ 0.1 µm | 108 |
| Bactérioplancton ≈ 1 µm | 106 |
| Pico-nanophytoplancton 0.5-20 µm | 104 |
| Nanozooplancton 2-20 µm | 103 |
| Microphytoplancton 20-200 µm | 103 |
Il est difficile de chiffrer la concentration idéale, elle dépend à la fois du spécimen et de la nature de la nourriture. On peut tenter de reproduire la densité de cellules du milieu marin, si toutefois on connait la concentration des cellules du plancton acheté, ce qui est souvent le cas du plancton vivant. Le tableau 6 donne, à titre indicatif, quelques indications sur la répartition des différents planctons en milieu naturel selon leur densité moyenne exprimée en cellules par millilitre. Le bactérioplancton cité ici agit en interaction avec le phytoplancton : il se nourrit des matières organiques libérées par le phytoplancton, formant un ensemble nourricier accessible aux polypes.
Tim Wijgerde suggère de distribuer selon l’une ou l’autre des méthodes suivantes : plusieurs fois, une préparation concentrée à raison de 10 à 103 particules par litre d’eau et d’ajuster selon les observations ou bien de maintenir dans l’aquarium une concentration « naturelle » de 108 à 109 cellules de phyto et bactérioplancton et 1 à 10 particules de zooplancton par litre d’eau.
On peut considérer que l’objectif de densité de particules est atteint lorsque les polypes se déploient pour la capter durant plusieurs heures. Ce résultat doit souvent être vérifié avec des moyens d’observation grossissants, en s’assurant que la capture n’est pas suivie d’un lâcher de la nourriture.
Chuck Stottlemire, un récifaliste Etats-unien a obtenu une croissance et la multiplication de Dendronephthya et Scleronephthya dans un aquarium dédé aux azoxanthellés.
Il utilise pour son aquarium de 680 litres, un mélange de 70 % de phytoplancton vivant commercial (Shellfish Diet 1800, un composé de 4 espèces de micro algues marines à 8 % d’extrait sec, représentant environ 2 billions de cellules par millilitre) et de 30 % de rotifères (RotiFeast, des œufs de Brachionus plicatilis). Cela représente 1.2 g d’extrait sec de phytoplancton pour 100 litres d’eau du bac par jour. La teneur en extrait sec des rotifères n’est pas communiquée. Il administre chaque jour ce mélange dilué à raison de 70 ml dans 7.6 litres d’eau, c’est-à-dire une concentration de 1 %, en goutte à goutte avec une pompe doseuse, sur 12 heures par jour. La densité planctonique peut s’observer par une légère teinte verte continuelle.
Cette quantité est supérieure aux taux naturels mais une partie reste probablement au niveau du sol, consommée partiellement par la faune bactérienne et contribuant peut-être au succès de cette maintenance. Une quantité supérieure semble entrainer des dérives des paramètres et la distribution continue contribue probablement à l’équilibre. La préparation quotidienne ne nécessite pas de refroidissement de la nourriture. Ces apports sont complétés quotidiennement par 9 ml de vodka et 12 gouttes de lugol. Le système et la maintenance restent simples, la cuve est éclairée par deux tubes T5. Les changements d’eau sont de 10 % par semaine.
L’aquarium est visible dans l’article Report on a succesfull husbandry method for a general azooxanthellate reef system including Dendronephthya .
4.4. Durée
Si l’on considère la faible probabilité qu’une particule de nourriture rencontre les tissus du corail, le délai entre sa capture et son assimilation, et la biomasse importante des Octocoralliaires par rapport aux coraux durs dont les tissus sont très fins, on comprend que la nourriture planctonique doit être distribuée durant de longues périodes. Cette durée doit être également proportionnelle à la biomasse des individus, un seul Sarcophyton massif nécessitant plus de nourriture qu’une colonie de Clavularia. Quelle que soit la nourriture, il est donc impératif d’étaler les distributions. On peut considérer qu’il faut au minimum trois apports de plancton (avec compléments) par jour ou idéalement, en léger goutte à goutte continu sur une douzaine d’heures. Les distributions sont effectuées en dehors des périodes de filtration. Leur fréquence et périodes dépendent du matériel employé. En effet, les pompes doseuses étant prévues pour injecter un volume minimum, on devra parfois adapter les dilutions et les intervalles de distribution. Certaines espèces ouvrent leurs polypes le jour mais d’autres, notamment celles non zooxanthellées, ne les ouvrent que la nuit. Il faut donc assurer au moins quelques distributions le soir, environ une heure après extinction des lumières.
4.5. Méthodes de distribution du phyto et zooplancton
Pour éviter de dépasser la densité acceptable de particules et ne pas provoquer la rétraction des polypes, il est préférable de ne pas délivrer les particules de nourriture juste dessus de la colonie mais en amont dans le courant, ces dernières devant arriver naturellement jusqu'aux polypes.
4.5.1. Distributions manuelles
Les préparations liquides se distribuent à la pipette. Les compléments peuvent être administrés une demi-heure avant le nourrissage ou, comme on l’a vu, incorporés dans la préparation. Cette méthode est particulièrement indiquée pour l’acclimatation des nouveaux spécimens. Elle permet une distribution ciblée tout en observant l’effet de la nourriture sur l’individu.
4.5.2. Distributions automatiques
C’est la méthode recommandée pour nourrir durant plusieurs jours, notamment lorsqu’on héberge des Octocoralliaires azooxanthellés. En effet, l’expérience montre que la disponibilité du soigneur se relâche à un moment et la régularité des distributions diminue au fil du temps, contribuant à la déchéance des spécimens fragiles.
4.5.2.1. Produits secs

La distribution directe de produits secs n’est pas recommandée. En effet, les particules flottent en surface et se dispersent mal. Si toutefois des fabricants venaient à créer des compositions adaptées, le distributeur à godet serait adapté. Il permet de préparer sur plusieurs jours des compositions différentes pré-dosées, éventuellement humectée de compléments liquides (attention à l’encrassement des coupelles). Les particules tombent alors dans un réceptacle, un anneau flottant sans fond, disposé à la surface de l’eau, qui évite leur dispersion le temps qu’elles s’imprègnent d’eau et coulent par gravité. Le système de distribution est positionné au-dessus d’une pompe de brassage.
4.5.2.2. Produits liquides distribués à température ambiante

La pompe doseuse (péristaltique ou autre) est adaptée à ce mode de distribution. La préparation est mélangée avec un peu d’eau du bac pour obtenir la dilution qui permettra de délivrer les quantités voulues en nombre suffisant et dont le volume sera au moins égal à celui autorisé par la pompe à chaque injection. Toutes les compositions nutritionnelles, même celles à flotabilité nulle qui stagnent dans la colone d'eau, ont une portion de particules qui flottent en surface et qui coulent au fond. Il faut donc impérativement maintenir la composition diluée en mouvement. Un récipient à fond conique ou concave se prête mieux à la remise en suspension des particules. 
La solution de l’agitateur magnétique qui présente de nombreux avantages (fiabilité, compacité, nettoyage...) est finalement la plus répandue. Signalons le système innovant Digidoseur+++PRO, proposé par Neo3plus, permettant de programmer une ou plusieurs distributions journalières selon plusieurs modes de dosage, avec une agitation avant le transfert de plancton liquide par pompe doseuse.
Le dispositif peut accueillir des préparations récemment préparées ou des cubes prédosés, congelés. La conservation des planctons ne dépasse pas 1 à 2 jours à température ambiante.
4.5.2.3. Produits liquides ou congelés maintenus et distribués frais
Une distribution autonome durant plusieurs jours, notamment en cas d’absence, nécessite de conserver la préparation au frais dans la même période. Un tel dispositif permet une autonomie d’environ une semaine. Il impose en plus de l’équipement de brassage et de distribution décrit ci-dessus, de quoi la réfrigérer.
Avant utilisation, diluer le mélange ou les cubes congelés, dans la quantité d’eau à distribuer dans l’aquarium.
La solution la plus employée (schéma) consiste à introduire le récipient de nourriture liquide ainsi que celui de brassage dans un réfrigérateur dédié à cet usage. Le brassage par agitateur magnétique s'avère adapté. Le mélangeur mécanique aussi quand on peut l'activer sur des périodes régulières et avant la distribution (Digidoseur+++PRO de Neo3plus). Les réfrigérateurs miniatures de 5 litres, basés sur le système de Peltier sont souvent trop petits et leur capacité de refroidissement parfois insuffisante durant les canicules. Un réfrigérateur refroidi par compression ou sorption sera plus sûr. Une capacité d'une trentaine de litres pourra accueillir l’ensemble des équipements (pompes doseuses, agitateur, venturi et tubing) à l'intérieur. Sa classe climatique est à choisir selon les températures ambiantes extrêmes : N (tempérée +10 à +32°C), ST (sub-tropicale +16 à +32°C), T (tropicale +18 à +38°C) ou SN-T (tropicale élargie +10°C à + 43°C) .

Le prélèvement de la nourriture est en général assuré par pompe péristaltique, intégrée dans le compartiment du réfrigérateur ou bien disposée à sa sortie. Pour éviter que de la nourriture stagne dans le tuyau à température ambiante, elle doit être évacuée immédiatement vers la cuve, dès sa sortie de la pompe doseuse. Ceci peut être obtenu au moyen d’un circuit de transfert de nourriture, constamment alimenté par une pompe dans l’aquarium, dédié à la circulation de l’eau qui emportera cette nourriture. Le tuyau de transfert doit avoir un diamètre suffisant pour accepter une gamme de viscosités et ne pas s’obstruer trop facilement et être de préférence opaque. La connexion entre le circuit de transfert de nourriture et la sortie de pompe doseuse doit empêcher tout retour d’eau vers la réserve de nourriture, notamment en présence d’un modèle de pompe doseuse de bas de gamme. Les clapets antiretour s’avèrent inopérants parce que régulièrement bloqués par les particules de nourriture. Un système efficace consiste à mettre en place un venturi. Ce dernier, transparent, permet de suivre l'évolution de l'inévitable encrassement ; il sera plus efficace en position haute dans le circuit. La sortie du circuit de transfert sera positionnée à l’endroit choisi au sein de l’aquarium pour que la nourriture soit dispersée par une pompe de brassage ou au contraire concentrée dans l'environnement de spécimens à cibler. Les circuits peuvent être équipés de vannes d'arrêt, simplement destinées à la désolidarisation des équipements pour les nettoyages qui ne manqueront pas de s’imposer régulièrement. L’automatisme de l’ensemble pourra être géré par un automate programmable ou un ordinateur.




Bien entendu, les aquariophiles ne tarissent jamais d’imagination, soyons sûrs qu’ils proposeront des systèmes plus simples répondant aux contraintes exigeantes du nourrissage. Notons que le nouveau système de distribution Digidoseur+++PRO cité plus haut, proposé par Neo3plus, peut être également placé dans un réfrigérateur pour administrer de manière simple, de la nourriture liquide fraîche.
4.6. Apports de bactérioplancton
L’assimilation de bactérioplancton par certains invertébrés filtreurs est communément admise. On ne sait pas encore avec précision quel est son importance en tant que nourriture, selon les espèces, ni les mécanismes de captage privilégiés. Qu’il soit directement piégé dans le mucus des coraux ou porté par les agglomérats de neige marine, il ressort que l’on peut avoir avantage à essaimer des bactéries dans la colonne d’eau, surtout pour élever certaines espèces sensibles. Dès lors, les récifalistes hébergeant des Octocoralliaires azooxanthellés imaginent toutes solutions.
Nous avons évoqué l’introduction de bactéries, directement dans la nourriture. Quelques aquariophiles ont suggéré d’essorer quotidiennement dans le bac, des éponges chargées d’une flore bactérienne. D’autres justifient partiellement leurs bons résultats au fait de remuer régulièrement le sable, cette pratique est cependant controversée puisqu’elle présente le risque de remettre en suspension des germes de bactéries pathogènes (Vibrio sp.). Le brassage d’un sable en couche épaisse n’est par ailleurs pas recommandé pour sa stabilité, d’autant plus qu’il présente un risque de sédimenter les tissus coralliens. Certains enfin ont mis en place des filtres à algues en partie pour exploiter cette faune bactérienne qui l’habite. Ces solutions aux effets incertains, ne sont malheureusement pas toutes facilement gérables et leur irrégularité ne permet pas de statuer sur leur efficacité. Par contre, un réacteur à bactérie, utilisé de manière stable, doit pouvoir répondre à cet usage.

Le réacteur à bactérie, traversé d’un courant d’eau ascendant, une fois que le substrat qu’il contient a été ensemencé, permet d’entretenir une flore bactérienne. Ici, l’idée est d’en évacuer une partie vers la cuve des Octocoralliaires et d’assurer le renouvellement de la population par l’apport éventuel de sources de carbone (alcool éthylique, glucose, vinaigre, acides aminés…), automatiquement par pompe doseuse. L'encadré ci-dessus, relatif aux RAB, définit un protocole d'utilisation. Le relargage vers la sortie d’une partie du mulm bactérien colonisant la surface du substrat, est obtenu en le remuant quotidiennement, deux à trois fois durant une minute et de préférence la nuit. Il se produit alors un léger trouble dans l’aquarium, révélateur du bon fonctionnement.
On trouve sur le marché des réacteurs à bactéries comme le Bio Churn de Grotech ou le RAB+++ de Néo3 plus. Le brassage du substrat, sur les réacteurs du commerce, est encore souvent réalisé manuellement en relevant la grille support au moyen d’une tringle et en l’agitant fermement. De rares réacteurs sont pourvus d'un système de nettoyage du substrat : le ZeoMatic 2 de Fauna marin utilise une pompe dédiée qui brasse les granulats ; le modèle Vibe de Avast marine Works, quant à lui, procède par vibrations. Si, contrairement à ces derniers, votre réacteur en est dépourvu, il est possible de l’équiper d’une seconde pompe externe, puissante, à la base de la colonne. Elle soulèvera énergiquement le substrat à intervalles programmés, en dehors des périodes d'écumage. Ce dispositif impose de placer une grille, en haut de la colonne du réacteur, empêchant le substrat de sortir. Il limite le choix des granulats qui ne devront pas être trop abrasifs comme le sont parfois ceratins charbons. La zéolithe plus lourde et cohésive ou les bio pellets qui se soulèvent plus aisément en lit fluidisé, semblent adaptés. D’autres équipements vendus sous le nom de filtre à lit fluidisé peuvent être ainsi modifiés.
Quelques récifalistes suggèrent de faire transiter la nourriture planctonique via le réacteur à bactérie en vue de la charger en bactéries alors plus facilement assimilables par les coraux.
4.7. Facteurs influençant le nourrissage
On ne connaît pas tous les facteurs qui font qu’un Nephtheidae se gonfle ou qu’une gorgone déploie ses polypes (quantité de nourriture, vitesse du courant, digestion, lumière excessive, prédateurs…). Un invertébré qui ne se gonfle pas ou ne se déploie pas régulièrement n’est pas forcément le signe d’un affaiblissement, mais c’est inquiétant lorsqu’il ne le fait jamais.
4.7.1. Morphologie des polypes
La morphologie des polypes de la colonie peut influer sur l'alimentation du corail. De grands polypes, comme en ont certaines gorgones telles que Subergorgia suberosa, offrent plus de résistance au courant et se déforment plus. Ils ne s’alimentent que dans une faible plage de courant. À l’inverse, des coraux à petits polypes comme Melithaea ochracea ou ceux maintenus dans une gangue de sclérites comme les gorgones Anthogorgia, tolèrent des vitesses importantes dans une plage plus grande. Ainsi, les polypes s’adaptent individuellement à la situation environnante, dans ce qui peut paraitre une stratégie de groupe, comme on va le voir. La taille des polypes influe également sur l’alimentation : des grands polypes peuvent capturer une plus grande quantité de proies et de plus grandes tailles. De grands polypes semblent également en mesure de procéder plus rapidement à une digestion externe.
4.7.2. Morphologie des colonies
Nous avons vu plus haut combien le flux du courant est important et qu'un brassage ne correspond jamais aux besoins de toutes les espèces. Fort heureusement, polypes et colonie peuvent agir ensemble pour moduler le courant localement afin d’en augmenter ou d'en abaisser la vitesse et permettre la capture de proies. L’observation des polypes sur la clonie permet d’avoir une idée sur la vitesse optimale du spécimen : par courant faible les tentacules des polypes dirigés sur le côté à contre-courant entrent en action ; en présence d'un courant intermédiaire ce sont les tentacules situés à l'aval tandis que dans des courants puissants, les polypes fléchissent en aval, créant des cavitations pour mieux capturer les proies par advection. On peut noter que cette adaptation, plus ou moins grande, détermine la distribution des espèces sur le récif : les espèces à petits polypes se répandent sur le front du récif, là où les courants sont puissants ; les espèces à grands polypes occupent plutôt le bas des pentes récifales ou les zones abritées. Ainsi, des polypes des colonies mal exposées s’ouvrent durant de trop courtes périodes, voire pas du tout. À contrario, des courants trop faibles ne stimulent pas les polypes. Les deux cas peuvent conduire à la régression du corail
5. Acquisition d’Octocoralliaires pour un aquarium récifal
5.1. Choix de la population d’Octocoralliaires
Plusieurs critères conduisent au choix d’une espèce :
5.1.1. Impact écologique
Les Octocoralliaires ne sont pas soumis à des quotas de prélèvement et d’importation. Pourtant, si la pérennité des espèces symbiotiques n’est pas à craindre, il en est autrement de certaines espèces azooxanthellées. Ces dernières ne peuvent, dans leur majorité, être bouturées et leur reproduction spontanée en captivité reste exceptionnelle. Elles sont donc toujours prélevées au stade adulte, à l’état sauvage, sur leur lieu de naissance.
Les gorgones azooxanthellées, plus particulièrement, ont une croissance lente en milieu naturel et leurs populations sont souvent si réduites qu’on peut les considérer comme rares. Peu d’entre-elles se reproduisent par voie asexuée, leur prélèvement inconsidéré conduirait très vite à un appauvrissement de l’espèce. Sauf en présence d'un système concu pour leur maintenance, on ne devrait pas les acquérir.
5.1.2. Facilité de maintenance
La réussite dans la maintenannce est fortement liée à la taille des polypes et essentiellement à la présence ou pas d’algues symbiotiques. Pour simplifier : la difficulté augmente quand la quantité de zooxanthelles et la taille des polypes diminuent. La taille des polypes d'une espèce, est une donnée difficile à obtenir (tout autant que celle de nombreuses nourritures de substitution) et il faudra parfois passer par des tests de nourrissage. Le caractère zooxanthellé ou azooxanthellé de nombreux genres est bien mieux déterminé, comme le précise le tableau 1 de l’article Octocoralliaires 1 - Biologie : classification et anatomie.
5.1.2.1. Espèces zooxanthellées

De nombreuses espèces de la famille Alcyoniidae, Clavulariidae et Briareidae, sont robustes, en mesure de prospérer durant des années dans le même aquarium, leurs boutures se propageant à volonté vers d’autres installations. Cette facilité de maintenance est liée à leur meilleure tolérance aux variations de la qualité de l’eau et à leurs algues symbiotiques. Ces espèces, largement dupliquées en mariculture sont fréquemment proposées à la vente. Ainsi les Alcyoniidés et plus particulièrement les genres Sarcophyton, Sinularia, Lobophytum, Klyxum, Cladiella, Clavularia et Briareum sont recommandés aux novices ou aux systèmes à filtration simplifiée. Ces espèces prolifèrent naturellement dans les environnements côtiers plus turbides, riches en éléments nutritifs et peuvent résister à une relative fluctuation de la salinité, de la température ou de nutriments. Les Nephtheidés zooxanthellés, comme Capnella et Nephthea se maintiennent et se bouturent également facilement. Les genres Xenia, Cespitularia et Anthelia, plus exigeants, prolifèrent quand les conditions sont réunies et stables. Les gorgones zooxanthellées des Caraïbes prolifèrent bien entre les mains des aquariophiles attentifs capables de fournir les conditions de courants qu’elles apprécient.
5.1.2.2. Espèces azooxanthellées

Les lignes qui précédent ont souligné les exigences de ces espèces qui rendent leur maintenance beaucoup plus compliquée, voire impossible quand celles concernant l’alimentation ne sont pas totalement remplies. En raison de leur faible espérance de vie en captivité, on ne peut que recommander aux récifalistes novices de s’orienter vers les espèces symbiotiques et aux autres, de ne pas succomber trop facilement à la beauté et à la disponibilité des espèces azooxanthellées, sans une mûre réflexion. Même des aquariophiles expérimentés se sont trouvés dans l’impossibilité de les conserver en vie au-delà de quelques semaines.
Les gorgones à petits polypes de la famille Acanthogorgiidae telles que Acanthogorgia (ex Acalycigorgia), Anthogorgia, Calcigorgia, Muricella ,comptent parmi les plus difficiles et ne devraient pas être acquise sauf installation dédiée. Selon K. Fabricius, les espèces de la famille Ellisellidae ainsi que le genre Subergorgia (à l’exclusion des espèces déplacées dans le genre Annella), sont plus robustes et moins sujettes aux infections.
Les Alcyonaires azooxanthellés, notamment Dendronephthya, Scleronephthya et quelques espèces du genre Paraminabea, poussent très rapidement dans des conditions idéales dans le milieu naturel et se propagent facilement de façon asexuée. Même si la taille des groupements n’atteint jamais celle d’Octocoralliaires zooxanthellés, on les trouve sur de nombreux récifs. Certaines espèces de Dendronephthya relativement robustes, à condition que les conditions de leur maintenance soient remplies, semblent mieux se prêter à la maintenance et à la propagation en captivité
5.1.3. Propagation
L’aptitude des Octocoralliaires zooxanthellés à guérir de leurs blessures et à régénérer leurs tissus, est exploitée par de nombreux récifalistes pour se livrer au bouturage de certaines espèces, parmi les plus faciles. Cette spécialisation aquariophile, comme la reproduction de poissons, contribue à la préservation de ces espèces sauvages même si elles ne sont pas directement menacées aujourd’hui.
On a peu de recul sur la maintenance des Octocoralliaires azooxanthellés et encore moins sur leur propagation asexuée en aquarium. Certaines espèces de Nephtéidés comme Scleronephthya se propagent facilement par stolon, il n’est pas exclu qu’il en soit de même en milieu clos. Les rares cas de bourgeonnement ou de scissiparité observés sur des Nephtéidés et Alcyoniidés, sont trop peu documentés pour tirer des conclusions. La propagation des espèces NPS n'aura probablement jamais l'ampleur qu'elle connaît avec les symbiotiques.
5.1.4. Esthétique

Si la couleur des Octocoralliaires est très variable du brun au rouge en passant par toutes les nuances violettes, jaunes, vertes et bleues, c’est bien souvent aussi leur souplesse qui conduit à leur choix. Dans un aquarium pourvu de Scléractiniaires, ils apportent une dynamique indéniable. Les formes sont diverses aussi, depuis les massifs Sarcophyton aux gorgones dentelées ou élancées, le paysage est variable à souhait. Les critères ci-dessus ayant limité le choix, il reste à choisir les espèces qui peupleront l’aquarium.
5.2. Sélection des spécimens
5.2.1. Identité

Le choix du spécimen convoité en magasin débute paradoxalement par une incertitude : celle de son identité réelle. De nombreuses espèces ne peuvent être identifiées au-delà de leur genre, à la seule vision de la morphologie, sans analyser les sclérites dans les différentes parties de l’individu. Ajouté à cela que l’individu collecté peut appartenir à une espèce non encore identifiée. Plus tard, l’amateur n’aura pas envie de prélever une branche de gorgone ou la portion d’un Alcyoniidé à la seule fin de lui attribuer un nom, l'incertitude risque fort de durer ! Selon les spécialistes, les erreurs sont très fréquentes, véhiculées en toute bonne foi sur le net ou dans le commerce aquariophile. Le doute subsiste même parmi les genres les plus courants comme Sinularia qui présente des formes très diverses. Quant aux espèces azooxanthellées, elles sont souvent réduites à des dénominations fourre-tout "Dendro", "Gorgone à polypes bleus"… sans souci de la réalité.

En fin d'article, quelques sources fiables permettent de s'essayer à une identification. On peut ainsi éviter quelques erreurs grossières par une simple observation visuelle : polypes monomorphiques (présence de polypes autozoïdes, seuls) ou dimorphiques (présence conjointe de polypes siphonozoïdes), polype contractile (s'il se contracte à la base du calice) et/ou rétractile (s'il s'enfonce en dessous du calice), présence de pied (pédonculé) commun, de tapis au départ du polype, présence ou non de polypes sur le pédoncule, détection ou non de sclérites sur les branches et/ou le pied, tentacules courts ou longs, présence de spicules sur le calice, calices proéminents ou peu élevés, polypes visibles sur une ou deux faces d'une gorgone... Le voile pourra être partiellement levé en observant, à la maison, les sclérites superficiels les plus voyants, sous macrophotographie (photo ci-contre).
5.2.2. Santé
Si les espèces symbiotiques sont mieux identifiées et généralement saines, à la vente, il n’en est pas de même avec les NPS, ce qui complique leur sélection lorsque que l’on convoite une espèce ou même un genre précis. Peu de vendeurs connaissent leurs besoins spécifiques et ils ne sont jamais équipés pour y subvenir durant de longues périodes en bacs de présentation. Sauf si le spécimen est fraîchement arrivé, son apparente santé n’est souvent due qu’à ses réserves énergétiques ; le plus souvent, il a déjà entamé une lente régression. Si le spécimen est vendu en VPC avec une photo prise à son arrivée, il faut malheureusement s’attendre à quelques différences avec le spécimen reçu.
Les Octocoralliaires, plus ou moins stressés au transport, on parfois besoin de longues périodes dans de bonnes conditions avant de commencer à s’épanouir et tout handicap initial diminue les chances de les maintenir. Les animaux non photosynthétiques privés longtemps de nourriture ou lésés lors des manipulations et des transports, ne s’alimenteront de nouveau que dans de très rares cas. Il est important de sélectionner des animaux sains ou le plus sains possible. Les espèces les plus délicates devront avoir été récemment prélevées dans le milieu marin et leur acquisition sera effectuée dès l’arrivage, cela nécessite une relation de confiance avec le vendeur. Les tissus doivent être intacts, sans trace de nécrose. Les Alcyonaires doivent être gonflés, sans trace de frottement avec des spicules appents. Un aspect étiré est déjà l’indicateur d’un dépérissement. Les polypes peuvent être ouverts en réponse à la faim, ce n’est pas en soi un indicateur de santé, sinon de malnutrition. Des polypes fermés ne sont pas obligatoirement le signe d’un dépérissement mais de stress ou également de malnutrition. Par contre, lorsqu’ils le sont constamment la prudence s’impose. De même, l'apparition de bourgeons ou de branches qui s’automutilent peut être un signe de détresse.












6. Accueil des spécimens
6.1. Transport
Les Octocoralliaires ne sont pas aussi rustiques qu'on le pense. Certains habitent des zones fortement brassées. D'une manière générale les Alcyoniinés (Alcyoniidés, Nephteidés...) et plus particulièrement les Xeniidés, sont sensibles à une baisse d'oxygénation. Il faut les transporter avec beaucoup d'eau, la tête en bas, accrochés à du polystyrène de telle sorte qu'ils soient en mouvement. Il faut également veiller à la tempérautre, faute de quoi ils peuvnet se désintégrer rapidement en une masse gélatineuse inerte.
6.2. Traitements et quarantaine
Les Octocoralliaires arrivent parfois parasités et leur support cache bien souvent des prédateurs potentiels comme les vers polychètes ou des nudibranches spécialisés. Ces derniers pourront rendre vaine la maintenance d’une espèce délicate pourtant acquise saine. Chaque spécimen doit impérativement être traité, au moins avec un produit à spectre large sur les plathelminthes tel que Coral RX ou Ultra Pest Control. Le chapitre « Soins » développe les traitements possibles selon les observations.
La « quarantaine » devrait être une étape obligatoire pour suivre plus longuement les spécimens, ceux présentant des lésions ou en cours de traitement prophylactiques. Le bac hôpital, de quelques litres à une dizaine de litres permet de réaliser des traitements variés qui seront généralement de courte durée.
6.3. Observations

La phase d’observation, n’est pas nécessaire pour les espèces robustes dont les principes de maintenance sont connus et maitrisés. Par contre, les espèces difficiles ou pour lesquelles on n’a pu réunir suffisamment d’informations, nécessitent une phase d’observation de quelques jours à plusieurs mois. Cette phase consiste à observer les comportements sur une période prolongée pour valider les meilleures conditions de maintenance, avant de les reproduire dans le bac d’exposition.

L’aquarium d'observation est de petit volume, une centaine de litres suffit pour analyser les détails. Ses équipements (brassage, intensité et spectre d’éclairage, nourrissage…) sont modulables afin de trouver les meilleures conditions de maintenance. Il n’y a pas de sable, sauf pour celles dont le pied s’enfouit en profondeur, comme les pennatules. Le décor permet de reconstituer différentes conditions d’exposition à la lumière (lumière indirecte, fixation au niveau du sol, accrochée à la pente, ou suspendus…) et de courants hydrauliques.
Les spécimens positionnés près de la vitre pourront être observés en gros plan, jusqu’au niveau du polype. À ce stade tout moyen d’observation microscopique de l’ordre de 4 à 400 X fournira des renseignements utiles : loupe grossissante, microspcope, mésoscope (Ogle d’Ogles, Nanoscope de D-D H2Ocean …), appareil photo avec objectifs macro et/ou lentilles, caméra macro reliée à un PC permettant éventuellement des prises image par image….
6.4. Acclimatation
Les spécimens arrivent plus ou moins stressés, il s’agit maintenant d’accoutumer le spécimen aux nourritures de substitution. Cette phase peut être conduite lors de l’observation ou parfois dans le bac d’exposition quand les conditions s’y prêtent.
Les meilleures conditions de maintenance étant établies et reproduites, le but est de redonner l’appétit. Les Octocoralliaires sont souvent présentés comme rustiques mais ils n’aiment pas les dérangements et mettent du temps pour déployer leurs tentacules. Dans un premier temps, il s’agit de déclencher l’ouverture des polypes. Cette étape peut être très longue dans le milieu captif, parfois plusieurs semaines, surtout quand les stress se sont accumulés depuis le prélèvement. Pour ce, on utilise des produits appétants tels que ceux à base d’acides aminés, des jus de bivalves éventuellement avec leur chair finement broyée (moules, huîtres...) ou des produits fermentés tels que le nuoc-mâm. Le produit est dispersé dans l’environnement immédiat du spécimen. Cett méthode est également pratiquée sur d'autres types d'invertébrés azooxanthellés (Tubastrea...), elle consiste à isoler le spécimen sous une cloche ou à le mettre à l'écart de la concurrence alimentaire, dans un bain (un seau) nutritif correctement dosé, en mouvement au moyen d'une petite pompe et qui ne polluera pas l'aquarium.
7. Mise en place dans l'aquarium
7.1. Sable corallien
Le choix de mettre du sable ou pas est un vieux dilemme qui divise toujours les récifalistes. L’article de Christian Seitz Sables et graviers, répond déjà à de nombreuses questions. Mais pas d’inquiétude, de nombreux aquariums sont maintenus avec succès et dans la durée, qu’ils en soient pourvus ou pas.
Ne pas en mettre c’est limiter l’accumulation de déchets et la sédimentation sur les tissus, faciliter le nettoyage, éviter les prédateurs fouisseurs (vers polychètes…), les parasites benthiques et les bactéries pathogènes qui peuvent l’habiter. Cette solution facilite la maintenance, elle est bien appréciée des débutants et recommandée durant la phase d’observation décrite ci-dessus.
Indépendamment de l’esthétique indéniable apportée par le sable et de son action bio épuratrice avérée, lorsqu’il est utilisé en couches épaisses (Jaubert, DSB…), que peut-il apporter puisque, finalement, peu d’espèces nécessitent de sable ? Il est bien entendu indispensable en présence d’espèces d’Octocoralliaires dont le pied est enfoui profondément (Studeriotes, Pennatules…). Le sable sera alors léger, de granulométrie très fine et la couche épaisse. Un sable d’aragonite très fin de type sugar, de 0,1 à 1 mm ou même des boues plus fines pourront faire l’affaire. On a l’assurance que la couche de sable convient quand le corail se gonfle régulièrement pour adopter une position verticale, sans chercher à sortir de son emplacement. La présence de sable très fin et léger est incompatible avec les espèces qui exigent des courants puissants, il pourra également stresser celles massives (Sarcophyton…) qui devront éliminer les dépôts trop fréquemment.
Certaines espèces se développent préférentiellement dans des environnements sableux, turbides, chargés de matières organiques. Les inconvénients d’une sédimentation des tissus, est alors probablement compensée par les apports nutritifs liés à sa présence. Cet apport encore mal mesuré n’est pas à négliger pour des filtreurs qui se nourrissent presque exclusivement par la capture de microparticules : depuis les matières organiques issues de l’action des détritivores, aux bactéries qui peuplent les couches superficielles, le sable doit pouvoir contribuer à la maintenance d’espèces difficiles.
Si l’on préfère mettre en place une couche épaisse selon Jaubert, DSB…, il faudra suivre les préconisations du protocole notamment en matière de granulométrie et d’épaisseur. Sinon, on pourra déposer une couche de 3 à 5 cm d’un sable d’aragonite, de granulométrie moyenne 2 à 3 mm qu’il faudra clocher occasionnellement. Si il n’est pas vivant, avant utilisation il sera brassé énergiquement plusieurs fois jusqu'à ce que l'eau ne soit plus laiteuse. Dans la mesure où le bac héberge des espèces azooxanthellées, il n’y a pas lieu de craindre l’apparition d’algues superficielles en raison du faible éclairement. Si l’on souhaite éviter tout contact avec les individus et limiter les aspects négatifs cités plus haut, on peut contenir le sable dans un refuge en amont du bac d’exposition.
7.2. Agencement du décor
Le décor conditionne à la fois la répartition des écoulements et l’exposition du corail dans le milieu, il doit donc être conçu avec réflexion. Les notes prises lors de l’observation pourront être utiles pour agencer le décor initial de l’aquarium (ou le ré-agencer lors d’introduction d’un individu) et définir le meilleur positionnement du corail. On peut aussi utilement observer le biotope et le positionnement des espèces sur les photos et vidéos prises in situ par les plongeurs.
Ainsi, le décor sera composé selon les cas de pierres vivantes légèrement inclinées telles une terrasse récifale exposée à la lumière, de pierres raides ou verticales simulant la pente externe ou un tombant propice à certaines gorgones. On pourra également reconstituer, en découpant à la meuleuse et en cimentant des pierres entre-elles, des grottes et des surplombs ombragés, des failles où le courant sera accéléré pour obtenir la vitesse souhaitée. De même les pierres rapprochées des vitres de l’aquarium augmenteront la vitesse d’un flux giratoire.
| Classe | Symbiose | Biotopes | Positions | Éclair. | Courants |
|---|---|---|---|---|---|
| Alcyoniidés | Zoox | Platier, crête et pente récifale, lagons. | Verticale | 3 à 4 | Cis. 2 à 5 Lam. 2 à 3 |
| Azoox | Grottes, surplombs, bas de pente récifale. | ⊥ parois | 1 | Lam. 1 à 2 | |
| Nephtéidés | Zoox | Parfois crêtes ; pente récifale externe moyenne, terrasses. Eaux claires à turbides. | Verticale | 3 à 4 | Lam. 2 à 3 |
| Azoox | Tombants, pente externe, failles, passes ou fonds sableux. Eaux claires profondes, parfois turbides des estuaires. | ⊥ parois, Verticale | 0 à 2 | Lam. 3 à 5 | |
| Xeniidés | Zoox | Eaux claires et parfois turbides. Pente récifale moyenne à basse, terrasses ; parfois fond vaseux. | Verticale | 3 à 4 | Cis. 2 à 4 Lam. 1 à 3 |
| Briareidae | Zoox | Habitat varié. Zones côtières, tombants, surplombs ombragés, Eaux plutôt turbides. | Plaqué sur roche | 3 à 4 | Cis. 2 à 4 |
| Gorgones Anthothelidae |
Zoox | Zones côtières, fonds boueux ; eaux turbides. | Verticale | 3 à 4 | Lam. 3 à 4 |
| Azoox | fonds boueux ; eaux turbides parfois clairs. | ⊥ parois, ⊥ courant |
1 à 2 | Lam. 4 à 5 | |
| Gorgones Subergorgidae | Azoox | Parois et pente récifale. | ⊥ parois, ⊥ courant |
1 à 3 | Lam. 4 à 5 |
| Gorgones Melithaeidae |
Azoox | Surplombs, failles, tombants. | ⊥ parois, ⊥ courant |
1 à 2 | Lam. 4 à 5 |
| Gorgones Acanthogorgiidae |
Azoox | Pentes profondes, tombants, failles, canaux, passes. | ⊥ parois, ⊥ courant |
0 à 1 | Lam. 4 à 5 |
| Gorgones Plexauridae |
Azoox | Eaux claires et turbides, profondes à très profondes. | ⊥ parois, ⊥ courant |
0 à 2 | Lam. 2 à 3 |
| Gorgones Gorgoniidae |
Zoox | Habitat varié, eaux peu profondes, turbides, à claires. Crêtes protégées, pente moyenne externe. | ⊥ parois, ⊥ courant |
3 à 4 | Lam. 3 à 4 |
| Azoox | Eaux turbides, estuaires vaseux. Pentes faibles, fonds sableux. | ⊥ parois, ⊥ courant |
1 à 2 | Lam. 2 à 3 | |
| Gorgones Ellisellidae |
Azoox | Eaux tropicales et tempérées, claires à turbides. Zones côtières, pente externe moyenne, fonds sableux parfois très profonds. | ⊥ parois, ⊥ courant |
2 à 3 | Lam. 3 à 4 |
| Gorgones Isididae |
Zoox | Eaux peu profondes moyennement claires. Pente moyenne externe. | ⊥ parois, ⊥ courant |
3 | Lam. 3 |
| Helioporacea | Zoox | Eaux peu profondes, claires >22°C. | Verticale | 3 à 4 | Cis. 2 à 4 Lam. 2 à 3 |
| Pennatulacea | Azoox | Fonds peu profonds à profonds, sableux, souples. | Verticale, pied enlisé | 2 | Lam. 2 |
Il est toujours intéressant de pouvoir démonter des éléments du décor pour traiter des coraux ou nettoyer une zone de l’aquarium, et de les installer de nouveau, tels qu’ils étaient. Ceci peut être obtenu en créant des modules stables, éventuellement empilables en les emboitant dans une position déterminée. On peut également fixer les supports de coraux au moyen de pitons. Recouvert ou dépourvu de sable, il sera nécessaire de nettoyer le fond du bac. Cette opération sera facilitée si ces modules portent sur trois pieds, laissant l’accès sous les pierres, la stabilité n’en sera d’ailleurs que meilleure.
Pour assurer un bon compromis entre un décor aéré et qui assure l’épuration biologique, le poids en kilogramme peut avoisiner 15 % du volume d'eau en litre, voire moins en complément de systèmes épurateurs performants. Plus que la quantité, la qualité des pierres est importante et c’est particulièrement vrai en présence de coraux NPS. Afin de ne pas contaminer le bac avec des éléments pollués et pour obtenir un équilibre biologique stable, Il est déconseillé d’utiliser de pierres mortes ou recyclées issues d’un autre bac dont l’historique est incertain. Il est préférable d’opter pour des pierres récemment importés ou des pierres inertes en céramique qui ont fait leurs preuves (Aquaroche, Riffkeramik…). Comme pour tout aquarium récifal, le protocole de démarrage doit être respecté et, pour assurer un ensemencement bactérien correct, les pierres seront traitées, tel que le décrit l’article de Christian SEITZ : Le conditionnement des pierres vivantes.
7.3. Positionnement et orientation des colonies
Les revues spécialisées et particulièrement les photos et vidéos de plongées, sont très instructives pour observer in situ, le positionnement des différentes espèces. Le tableau 7 détermine de manière succincte ceux généralement observés.
La vitesse de l’eau diminuant drastiquement à l’approche du substrat, on peut surélever le pied des Octocoralliaires qui se plaisent dans les courants forts. Nombre de Nephtéidés azooxanthellés (Dendronephthya…) sont souvent suspendus aux surplombs, dans la partie supérieure des grottes ou bien inclinés le long de pentes et de failles, dans un courant portant, de telle sorte qu’en se dégonflant ils restent à l’écart des organismes de sol. De même, il semble important d’éviter tout contact, c’est-à-dire toute usure ou lésion, avec le substrat.

 Scleronephthya sp. est placé dans l'accélération du courant.
Scleronephthya sp. est placé dans l'accélération du courant.

Les gorgones dont le morphe est en éventail et qui affectionnent les courants forts sont fixées perpendiculaires à celui-ci et, selon le genre, verticalement ou accolées à la paroi abrupte. L’observation du spécimen à l'achat, fournit quelques indices quant à son orientation dans le courant. Les polypes plus développés sur une face d’une gorgone sont le plus souvent en aval d’un courant fort ou en amont d’un courant faible. La courbure d’un Nepthea détermine approximativement son inclinaison pour s’écarter de la paroi.
8. Cohabitations et facteurs de stress
Dans la nature, coraux Scléractiniaires et Octocoralliaires se côtoient, mais on assiste parfois à l'envahissement total du territoire par ces derniers, en mesure de libérer de fortes quantités de toxines. Il en est également ainsi dans les aquariums mixtes : un milieu clos exacerbera les effets toxiques des Octocoralliaires à forte biomasse et, au-delà d'une certaine densité d'Alcyoniidés et de Nephtéidés, la situation peut devenir insoutenable pour les coraux durs au point de stopper leur croissance et de s'affaiblir jusqu'à blanchiment du corail.
Le système de nourrissage, déployé pour les Octocoralliaires azooxanthellés, rend l’aquarium tout à fait compatible avec quantité d’autres invertébrés également suspensivores microphages. Ainsi, sous réserve que les techniques de maintenances soient maitrisées, pourront cohabiter : coraux, sabelles, ascidies, holothuries, éponges, bivalves, comatules, antipathes…
8.1. Cohabitations utiles
Il sera parfois utile d’introduire des animaux prédateurs d’organismes parasites des Octocoralliaires comme le Poisson-papillon Chelmon consommateur d’Aipatsia en cas d’explosion de cette anémone, ou les crevettes du genre Stenopus friandes de vers polychètes. D’autres comme les bivalves, tuniciers, éponges… pourront contribuer à absorber des métaux lourds. Les pics de pollution susceptibles de se produire lors de l’alimentation des espèces azooxanthellées seront mieux pris en charge par une biodiversité comprenant des détritivores (gastéropodes, microcrustcés, vers) qui dégraderont les déchets et biofilms, et dont les larves pourront nourrir les filtreurs. La liste est longue !
8.2. Parasites et prédateurs

Poissons corallivores, planaires, mollusques gastéropodes ou nudibranches, annélides polychètes, crustacés, étoiles de mer…, ils ne manquent pas. Vous trouverez d’amples informations dans le sujet Parasites et prédateurs du précédent article Octocoralliaires 3 – Écologie. On peut rajouter qu’Octocoralliaires et poissons n’ont pas le même régime alimentaire. La charge de nourriture qui peut devenir importante doit être traitée en conséquence. La population de ces derniers devra être raisonnable en présence de NPS.

La faune cryptique qui se déplace sur le décor la nuit venue, peu déranger l’ouverture des polypes. C’est le cas de quelques crabes. Les crevettes Lysmata habituellement rencontrées dans les aquariums récifaux, progressent sur les colonies à la recherche de nourriture. Elles les dérangent temporairement et les privent de leurs proies, sans révéler de détérioration des tissus.
Il existe des prédateurs naturels comme de nombreux nudibranches, chacun spécialisé dans un genre limité d’Octocoralliaires et qu’il faut écarter rapidement. Des planaires, notamment Waminoa spp. et de nombreux genres de copépodes envahissent régulièrement les tissus. Rappelons les redoutables destructeurs des Octocoralliaires que sont les vers polychètes, notamment les vers de feu. Ils occupent les roches et creusent en remontant, détruisant les tissus internes, sans que l’on constate quoi que ce soit, jusqu’à l’affaiblissement et la mort de la colonie. Leur présence fréquente pénalise plus particulièrement la maintenance des espèces difficiles. Il faut donc éradiquer ces parasites à l’arrivée du spécimen tout autant que par la suite.
9. Soins
Les progrès dans la technique, dans la connaissance des espèces et des processus biochimiques ainsi que dans les méthodes de maintenance captive, ont permis d’améliorer la santé des aquariums récifaux. Les pathologies sont mieux décrites, les maladies moins fréquentes, mais quand elles se déclarent, l’aquariophile est tout aussi désemparé. L’idéal est de connaitre la source du mal et ce qui l’entretient : stress environnemental, attaque parasitaire, maladie bactérienne ou virale… ce qui n’est pas toujours facile. Le sujet Agents pathogènes, maladies a été abordé dans Octocoralliaires 3 – Écologie , il fournit quelques pistes pour les identifier et les traiter.
9.1. Traitements biologiques
Il s’agit d’exploiter un vrai prédateur du parasite dont on souhaite se débarrasser. Autant que possible, il faut privilégier cette lutte biologique dont l’impact sur l’équilibre du bac est moindre, quoi qu’il existe toujours un risque quand on ne connaît pas le comportement de cet auxiliaire après la disparition du parasite. La méthode impose donc une bonne connaissance du parasite et de son prédateur. Le tableau 8 propose quelques modes de traitements biologiques.
9.2. Traitements physiques
Des actions sur le système de maintenance peuvent être une réponse rapide, sans risque, aux premiers symptômes de maladies :
- Changement d'eau : ils n’ont d’effet que s’ils sont importants de 30 à 50 %.
- Bains d'eau douce : si les scléractiniaires et notamment les SPS supportent souvent mal ce traitement, il s’avère efficace sur les Octocoralliaires contre les planaires. L’immersion dans l'eau douce à la même température que celle du bac est de l’ordre de la minute en fonction du décollement des parasites.
- Nettoyage : Sectionner les portions du corail infecté et nettoyer les zones saines. Colmater les éventuels accès des vers prédateurs à la base des gorgones, à l’époxy.
- Bouturage : le plus tôt possible, sectionner les portions saines du corail et les baigner dans une solution de Lugol, à raison de 2 à 3 gouttes par litre durant quelques minutes.
- Ozone ou UV: pour diminuer la population de bactéries libres dans la colonne d’eau.
9.3. Traitements chimiques, médicaments
Il s’agit de détruire le parasite par utilisation d'un produit chimique. Lorsque l’utilisation de la lutte biologique est inefficace ou impossible, la lutte chimique est envisageable. Sauf si des tests préalables ont démontré l’absence totale d’effets indésirables (déséquilibres bactériens, modification de la composition chimique de l’eau, stress sur les animaux) ou lorsque c'est préconisé par le fabricant, on ne traite jamais dans l’aquarium récifal principal. On procède par des bains, dans une cuve annexe.
Méthode des bains :
- Écarter les individus, ou portions de colonies, affectés ;
- remplir le bac hôpital de quelques litres avec l’eau salée du bac, à la température d’origine ;
- incorporer le produit au dosage indiqué et mélanger ;
- introduire le corail et attendre la durée prescrite ;
- agiter le corail, utiliser éventuellement une pompe, pour déloger les parasites ;
- rincer le corail dans un récipient contenant l’eau du bac ;
- vérifier l’efficacité du traitement, poursuivre si nécessaire.
9.3.1 Traitements
| Parasite | Effets | Traitements possibles (efficacité variable selon l’espèce du parasite) |
|---|---|---|
|
Planaires Nombreux genres (Waminoa, Convolutriloba, Heterochaerus…) |
Lésions superficielles, petits cercles clairs, affaiblissement général, envahissement. Les larves peuvent s'enkister dans les tissus en protubérances de Ø 3 à 5 mm, parfois sur une surface importante et rester en latence des années sans gêner le corail. |
Biologique - Poissons : Synchiropus picturatus, S. ocellautus, Pseudocheilinus hexataenia: Anampses spp., Halichoeres melanurus, H. leucurus, H. chrysus, H. marginatus, H. viridis, Thalassoma lunare, T. hardwicke… - Crevettes et crabes symbiotiques. - Nudibranches : Chelinodura varians, Berghia verucicornis Chimique Anthelminthiques : lévamisole, praziquantel, iode, lugol, povidone iodée (Betadine), Compositions commerciales: Tremazol (praziquantel) de Sera ; Coral Rx, Ultra Pest Control, Flatworm exit, Salifert Flatworm control Blue Life, Flatworm solution, Pro Coral Cure de Tropic Marin, Coral dip solution de Precision solution, Flatworm Stop de Korallen-Zucht (traitement dans le bac), Hydrogent d'ECOBIO |
|
Copépodes Nombreux genres |
Affaiblissement, décolorations, perte de zooxanthelles, polypes contractés... Vecteurs de maladies bactériennes. Les larves peuvent percer le tissu et s'enkyster en formant des protubérances (galles). |
Biologique - Poissons : Corythoichthys haematopterus Chimique Des éradications sont constatées sur SPS avec Insecticides : Confidor de Bayer (imidacloprid) ; Thiacloprid ; Interceptor (oxime de milbémycine). Anthelminthiques : Tremazol (praziquantel) de Sera ; PraziPro (praziquantel) de Hikari ; Sentinel Spectrum (oxime de milbémycine, lufenuron et praziquantel) ; Milbemax (oxime de milbémycine et praziquantel). |
| Bactéries | Dégénérescence tissulaire |
Chimique Antibiotiques : Chloramphenicol Bactéricide virucide et fongicide : Hydrogent d'ECOBIO (acide peracétique et peroxyde d'hydrogène) |
9.3.2 Médicaments
- Lugol : utilisé dans le bac principal en vue de diminuer le nombre de bactéries dans la colonne d'eau, à raison de 1 goutte pour 120 litres, durant plusieurs jours, sans dépasser le dosage. Également utilisé en bain annexe pour traiter un corail, à raison de 5 à 15 gouttes de Lugol par litre d’eau salée, durant 5 à 15 minutes. Concentration et durée doivent être augmentées progressivement selon la résistance du corail.
-
Antiparasites : l’efficacité des produits anthelminthiques (vermifuges) est assez inégale et l’action des insecticides encore mal définie.
Andrew et Lynford ont noté une relative efficacité, mais pas totale, avec Coral RX, sur plusieurs espèces de planaires. Le praziquantel est un puissant anthelminthique concentré liquide prêt à l'emploi, développé contre les parasites dans les étangs ou en aquarium marin. Il ne semble pas avoir d'impact négatif sur la filtration biologique, les poissons ni les invertébrés. Il ne nécessite généralement pas de changement d'eau après traitement en bac principal. Il est souvent associé à l'oxime de milbémycine pour étendre le spectre de son action. L'oxime de milbémycine est un antiparasitaire vétérinaire à spectre large, notamment comme anthelminthique et acaricide. Le produit est efficace contre les parasites copépodes, mais n'épargne pas la microfaune. Des témoignages et posologies sont consultables sur ces liens : lien1, lien2. -
Antibiotiques : destinés à lutter contre les bactéries pathogènes.
Le chloramphénicol a été utilisé contre les RTN des SPS. C’est un produit vétérinaire en poudre.
Bingman recommande le protocole suivant : réaliser un premier bain de Lugol comme ci-dessus ; baigner ensuite le corail dans le bac hôpital équipé d’une pompe de brassage (pas de pompe à air) ; verser le Chloramphénicol dissous dans de l'alcool pur (environ 100 mg/ml). Doser dans le bac hôpital, à raison de 20 à 50 mg/l de Chloramphénicol par litre d’eau de mer durant 24 h ; changer l’eau, remettre l’antibiotique et rajouter 5 à 10 gouttes de lugol par litre durant 15 minutes. Remettre le corail dans le bac principal. Détruire l’antibiotique en désinfectant le bac hôpital à l’eau de javel durant quelques heures. L’Hydrogent d’ECOBIO est un mélange d’acide peracétique et de peroxyde d’hydrogène. Il pourrait s’agir d’un traitement efficace contre les pathologies rencontrées en aquarium : permet de détruire l’ensemble des microorganismes : bactéries, champignons, algues et virus, ainsi que les ectoparasites de type Plathelminthes et semble-t-il les Aiptasia. La posologie est documentée dans la notice de l'Hydrogent. Dans tous ces cas de figure, le taux de survie des animaux est extrêmement élevé.
Par prudence et parce que les produits actifs varient d’une formule à l’autre, les modes de traitements et posologies n’ont pas été systématiquement détaillés. Les intéressés pourront consulter les publications sur le net pour définir ce qu’il convient d’adopter dans leur cas.
Une maladie peut anéantir un aquarium, quand ce n’est pas la propre motivation du soigneur. Les résultats des traitements ayant toujours une part d’incertitude, la meilleure de toutes les méthodes reste la prévention en pratiquant la quarantaine comme cela a été exposé plus haut, et de réagir rapidement aux dérives.
10. Reproduction et bouturage
Fort heureusement, le traitement des maladies n’est pas la principale activité liée à la maintenance des Octocoralliaires. Comme on l’a vu au chapitre 5 de l’article Octocoralliaires 2 - Biologie : nutrition, reproduction, dans la nature, ces derniers assurent leur survie en se propageant par reproduction asexuée et en régénérant leurs tissus blessés. Les fermes d’élevage, tout comme les amateurs aquariophiles, exploitent chaque fois que possible les mêmes principes pour limiter les prélèvements sauvages, pour assurer la pérennité de leurs propres collections et pour échanger les espèces. Et puis la reproduction, même asexuée, n’est-elle pas le graal de la maintenance d’espèces vivantes ?
Les techniques sont plus ou moins efficaces selon les espèces. Celles symbiotiques, disposent toujours de suffisamment d'énergie lumineuse pour subvenir à leurs besoins pour mieux supporter le stress, leur croissance est également plus rapide, elles s’y prêtent donc particulièrement bien.
10.1. Cas des morphes mous adhérant au substrat → Lacération
C’est la méthode la plus simple qui consiste à trancher au scalpel une portion de la base d’un spécimen accrochée à son support. La partie découpée se sépare et, en quelques semaines, deux individus se développent de manière autonome.
10.2. Cas des morphes massifs d’espèces robustes → Fragmentation
C’est la méthode la plus pratiquée, sur les spécimens massifs de Nephtéidés et Alcyoniidés. Cette méthode est stressante pour le corail qui produit beaucoup de mucus. Les parties découpées sont sensibles aux infections bactériennes. Pratiquée massivement ou sur des individus massifs, les toxines libérées peuvent dérégler un bac, aussi est-il préférable de procéder à l’extérieur du bac principal et de filtrer sur charbon actif :
- Découper le spécimen au scalpel ou des ciseaux aiguisés, en un ou plusieurs morceaux, en prenant soin de conserver une zone de tissu externe.
- Positionner la portion de corail, la zone tranchée vers le substrat, l’ectoderme vers l’eau.
- Maintenir cette portion dans la partie concave du support en s’assurant qu’elle n’est pas serrée une fois gonflée :
- bouture importante, et ferme (coraux cuirs…) : tenue par des élastiques, fixée par un cure dent, bloquée dans un coin… ;
- bouture petite et ferme : par collage à la colle cyanoacrylate sur un support plan et lisse ;
- espèces gluantes, peu denses et fragiles (Cladiella…) : par un grillage large ou tout autre système l’empêchant de glisser ou de se cisailler. - Déposer le support dans un endroit non sédimenté, brassé de façon à dégager les mucus et assurer la respiration de l’animal, mais sans excès.
- Le spécimen se cautérise normalement en quelques jours, surveiller cependant l’absence d’infection bactérienne :
- Il se fixe au substrat en une à deux semaines et entame un bourgeonnement en 2 à 3 semaines ;
- libérer la bouture après quelques semaines ou dès qu’elle s’est solidement fixée.
10.3. Cas des morphes massifs d’espèces délicates → Étranglement
L’étranglement d’un rameau de quelques polypes peut être provoqué en le coupant partiellement. Le fragment encore attaché à la colonie et dans le même environnement, cicatrise puis finalement se détache et se fixe sur le support que l’on aura choisi. Cette méthode, peu stressante parait mieux adaptée aux espèces difficiles. Quelques succès ont d’ailleurs été relatés sur des espèces azooxanthellées. Une reproduction a été obtenue à partir de l’auto étranglement d’une branche de Dendronephthya, laissée librement dans une anfractuosité sous un léger courant.
10.4 Cas des morphes à squelette interne → Fragmentation
Cette technique s’applique aux gorgones :
- Couper une branche et dénuder à la base, le squelette interne (comme un fil électrique) ;
- introduire ce squelette dépourvu de tissus dans un trou adapté à son diamètre ;
- le fixer au mastic époxy, les tissus recouvriront la colle en consolidant la fixation.
11. Pour conclure
Un peu en marge de l’aquariophilie récifale actuelle, ces articles généralistes aideront-ils les amateurs à rendre aux Octocoralliaires la place qu'ils méritent ? À n’en pas douter, ces coraux mous, mous-durs, mi mous mi durs et parfois durs, peuvent être des "durs à cuire". Des plus faciles à ceux qui restent impossibles à tenir, ils représentent les extrêmes de ce que l’on peut trouver dans l’aquariophilie récifale. Ils n’ont pas encore révélé tous leurs potentiels dans un aquarium d’exposition. Les récifalistes ont encore beaucoup à apprendre pour maintenir certaines espèces qu’il faut appréhender avec toute l’humilité dûe à notre ignorance. Si ce n’est pas pour mettre en œuvre toutes les chances de leur survie, respectons leurs mystères en ne les achetant pas.
Le plus important de nos observations et de nos progrès dans leur maintenance reste à partager… encore et toujours, sur le forum de Cap récifal.
Références
- D. I. Rubenstein; M. A. R. Koehl. The Mechanisms of Filter Feeding: Some Theoretical Considerations. The American Naturalist, Vol. 111, No. 981. Sept, oct 1997.
- The food of reefs Part 1 – Part 7 – Reefkeeping, janvier 2003 – avril 2003.
- R. L. Shimek. The Reef Aquarium Consequences of Suspension-Feeding as a Way of Life. Reef.org.
- T. Wijgerde, F. Houlbrèque, C. Ferrier-Pagès. How Corals Feed.Coralscience.org. 2009. Lien pdf.
- Tim Wijgerde, Ph.D. Coral Feeding: An Overview, Advanced Aquarists, Vol 12. Décembre 2013
- T. Wijgerde, P. Spijkers, E. Karruppannan, J. A. J. Verreth, R. Osinga. Water Flow Affects Zooplankton Feeding by the Scleractinian Coral Galaxea fascicularis on a Polyp and Colony Level. Hindawi Publishing Corporation, Journal of Marine Biology Volume 2012, Article ID 854849, 7 pages. Lien pdf.
- K. E. Fabricius and G. De'ath. Biodiversity on the Great Barrier Reef: Large-Scale Patterns and TurbidityRelated Local Loss of Soft Coral Taxa. Oceanographic Processes of Coral Reefs. 2001
- K. E. Fabricius, A. Genin, Y. Benayahu. Flow-dependent herbivory and growth in zooxanthellae-free soft corals. American Society of Limnology and Oceanography, Inc. 1995.
- K. E. Fabricius, P. Alderslade. Soft corals and sea fans – A comprehensive guide to the tropical shallow-water genera of the Central-West Pacific, the Indian Ocean and the Red Sea. Australian Institute of Marine Science, Townsville, Australia. 2001. 264 p
- M-C Lin, C-M Liao, C-F Dai. Modeling the Effects of Satiation on the Feeding Rate of a Colonial Suspension Feeder, Acanthogorgia vegae, in a Circulating System under Lab Conditions. Zoological Studies. Juin 2002
- K. P. Sebens, A. S. Johnson. Effects of water movement on prey capture and distribution of reef corals. Hydrobiologia, vol. 226, no. 2, pp. 91–101, 1991.
- M. R. Patterson. Patterns of whole colony prey capture in the octocoral, Alcyonium siderium. Biological Bulletin, vol. 167, no. 3, pp. 613–629, 1984.
- Bedienungsanleitung zum SEA FAN und Dendro SYSTEM von Fauna Marin, (Traduction française de Denis Tournassat, sans engagement : Manuel Sea Fan System et Dendro System). Version 2010-1.
- J. C. Delbeek. Coraux mous non-photosynthétiques. Récif France. Avril 2011.
- J. C. Delbeek, M.Sc. Non-photosynthetic Corals: They really are hard. Advanced Aquarists, 2002.
- J. Adams. Water Flow is More Important for Corals Than Light, Part V. Advanced Aquarists, Vol 6. Janvier 2007.
- F. Marini, Ph.D. Martin Moe. The Breeder's Net: Culture Of Mysid Shrimp And Bivalve Trochphores (veligers). Advanced Aquarists, septembre 2003.
- D. Riddle. How Much Light?! Analyses of Selected Shallow Water Invertebrates' Light Requirements. Advanced Aquarists. Mars 2007.
- S. Graber. Why do soft corals like Xenia pulse? Advanced Aquarists. Avril 2013.
- L. Colon, O. Soulat. Coraux durs et invertébrés parasitaires. Cap récifal. Novembre 2013.
- P. Madl. The Silent Sentinel... The demise of tropical reef. site web Horizon.
- T. Wijgerde. Improved husbandry of marine invertebrates using an innovative filtration technology - Part 1: DyMiCo. Advanced Aquarists. Février 2012.
- F. Lesage. Le dosage du carbone organique. ZebrasO'mag n°28, 2014.
Identifications des Octocoralliaires
- J.A. Sanchez, H. H. Wirshing. A Field Key to the Identification of Tropical Western Atlantic Zooxanthellate Octocorals (Octocorallia: Cnidaria). Caribbean Journal of Science, Vol. 41, No. 3, 508-522, 2005.
- K. E. Fabricius, P. Alderslade. Soft corals and sea fans – A comprehensive guide to the tropical shallow-water genera of the Central-West Pacific, the Indian Ocean and the Red Sea. Australian Institute of Marine Science, Townsville, Australia. 2001. 264 p
- Site web. South Florida Octocorals - A guide to identification. NSU Oceanographic Center. Florida USA 33004. Guide interactif d'identification des gorgones de Floride.
- M. Grasshoff, G. Bargibant. Les gorgones des récifs coralliens de Nouvelle Calédonie. IRD Éditions, 2001.
- K. E. Fabricius, G. De'ath. Soft coral atlas of the Great Barrier Reef. Australian Institute of Marine Science, Townsville, May 2003.
- H. Andrew, M.S. Lynford. Evaluation of Chemical Eradication Methods of Acoels (Acoelomorpha) From Marine Aquaria. Advanced Aquarists, avril 2009.
- J. Sprung, J.C. delbeeck. L'aquarium récifal volumes 2. Ricordea Publishing, Florida USA, 1999.
- J. Sprung. Coraux Guide pratique d'identification et de maintenance. Collection Océanographie. Ricordea Publishing, Florida USA, 2000.
Maintenance d’Octocoralliaires azooxanthellés
- C. Matthews. Report on a succesfull husbandry method for a general azooxanthellate reef system including Dendronephthya – (Chuck Stottlemire's Method). Reefkeeping février 2008.
- New Dendronephthya sp. study group– Sujet de discussion. Reef Central
- E. Borneman. Drendonephtya–- Reefs.org
- M. P. Janes. Husbandry of azooxanthellate soft corals (Anthozoa: Octocorallia) in captivity: preliminary results. Public Aquarium Husbandry Series, vol. 2. R.J. Leewis and M. Janse (eds.), pp. 61-73. 2008 Burgers’ Zoo, Arnhem, the Netherlands.
- M. Cao. Mike Cao's Non-Photosynthetic Reef. Advanced Aquarists, 2011.
- T. Wijgerde, Ph.D. Experimental aquaculture of Dendronephthya corals. Advanced Aquarists. Juillet 2015.
- T. Wijgerde. Improved husbandry of marine invertebrates using an innovative filtration technology - part 2 : results with two 12 cubic meter DyMiCo systems. Advanced Aquarists. Mars 2012.
- K. E. Fabricius. Ecology and Nutrition of Azooxanthellate Octocorals. Corals.
- Sujet de discussion : Continuous feeding NPS filter feeders. Reef central.
Tous mes remerciements aux auteurs des photos pour leur accord de publication et à Dominique PAILLER, Philippe PALUDETTO, Christian SEITZ et Olivier SOULAT pour leur soutien.
Denis TOURNASSAT
Article publié par Cap récifal le 1 février 2015 avec l'aimable autorisation de l'auteur.
Modifié par Denisio


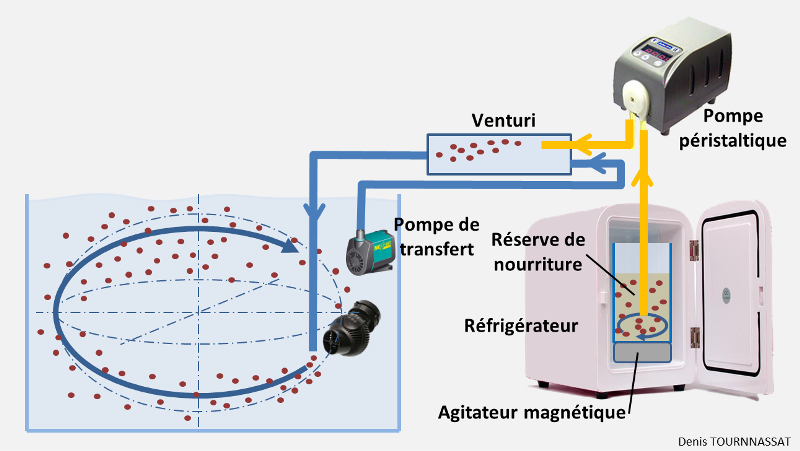


Commentaires recommandés
Il n’y a aucun commentaire à afficher.