
Cet article relate notre expérience et nos essais dans cette entreprise. Souvent, cela se traduit par des journées de travail pour un résultat nul. Un résultat nul, certes, mais une expérience acquise énorme.
Nous n'avons pas la prétention, par ce travail, de réaliser une étude exhaustive de la reproduction des poissons marins mais celle de compiler, à partir de sources bibliographiques facilement accessibles et d'expériences personnelles, des données dans ce domaine. L'objectif de cet article est de présenter un exemple concret de reproduction. Le cas réalisé est celui des poissons-clowns : Amphiprion ocellaris.
Plus qu'un simple article décrivant le mode d'emploi pour reproduire des poissons-clowns, nous avons voulu détailler nos échecs, essayer de les expliquer et montrer également qu'il n'y a pas qu'un seul protocole, mais de nombreux chemins dont tous n'ont pas encore été tentés.
Nous ne nous sommes réellement intéressés à la reproduction qu'à partir de 2003 lorsque nos premiers clowns se sont mis à pondre. Mais suite à des déménagements successifs, nous n'avons tenté de les reproduire qu'en 2004. Et quel plaisir de voir ces « petites virgules » sortir de l'œuf et évoluer au fur et à mesure jusqu'à la métamorphose où les bandes blanches apparaissent successivement. Bref, une expérience à tenter, et que je souhaite à tout aquariophile. Mais arriver à des résultats demande un peu de travail, de recherche, de méthodologie, et un brin de chance…
Avant toute chose, pour se lancer dans la reproduction, il faut maîtriser une partie de la chaîne alimentaire. Il est difficile d'expliquer toutes nos démarches sans connaître auparavant la reproduction des poissons en eau de mer. La difficulté majeure de l'élevage est de fournir la nourriture convenable pour les larves. La première partie de cet article nous permettra de développer ce qu'est le plancton et surtout comment on arrive à le maintenir et à le développer dans de bonnes conditions. En effet, connaître ces organismes, leur biologie, leur cycle de vie est indispensable avant de se lancer dans la culture. Dans un second temps on s'intéressera à une espèce que nous avons reproduite et que nous continuons à reproduire : Amphiprion ocellaris.
1. Quel est l'intérêt de prendre des poissons d'élevage ?
Actuellement, moins de 10 % des poissons d'aquarium marin sont élevés en captivité, contrairement à l'eau douce où 90% des espèces proviennent d'élevage. L'élevage larvaire est d'autant plus délicat que la larve est petite à la naissance et que le stade larvaire est long. En tant que « consommateur », on peut se poser légitimement la question de pourquoi privilégier le poisson issu de l'élevage par rapport au poisson capturé dans la nature. La principale réponse est bien évidemment d'éviter un prélèvement dans le milieu naturel. Toutefois, le prélèvement pour l'aquariophilie représente dans la grande majorité des cas un impact faible sur la survie de la population. Il existe d'autres raisons de favoriser les poissons d'élevage :
- Ces derniers consomment tous les types d'aliments, l'éleveur privilégie une alimentation riche et variée. Les poissons acceptent la nourriture inerte.
- Ils sont indemnes de parasites sauvages sauf s'ils sont passés par des bacs de ventes non dédiés à ce type d'animaux et qui ont hébergé des animaux malades.
- On parle souvent d'une moins grande agressivité notamment du fait qu'il se sont développés dans un environnement sans prédateurs.
- Ils sont également plus enclins à supporter le transport et les diverses manipulations.
Toutefois, il existe des inconvénients, notamment lors de l'introduction de poissons d'élevage dans un bac présentant des animaux prélevés dans le milieu naturel. Les poissons d'élevage risquent d'être plus sensibles aux maladies présentes dans le bac du fait d'une absence d'interaction avec le parasite comme cela est le cas dans le milieu naturel.
L'objectif de cet article est d'impliquer les amateurs d'aquariums marins dans l'élevage en captivité d'organismes marins. C'est également une expérience très intéressante qui ne demande que peu de moyens financiers, seulement un peu de temps. Ainsi, la curiosité et le challenge sont les moteurs de la réussite de l'élevage. Si vous avez un peu de temps, de la patience, un brin d'organisation, nous vous encourageons vivement à tenter cette aventure.
2. Ce qu'il faut savoir pour bien débuter une reproduction
Le principal problème rencontré dans l'élevage des poissons marins est de trouver une nourriture appropriée. La taille de la proie joue bien-sûr un rôle prépondérant mais d'autres facteurs également influencent considérablement la chasse, tels que l'appétence et le mouvement de la nage. Comme on le verra par la suite, susciter une réaction alimentaire est un enjeu essentiel pour la capture.
Mais les poissons marins ont également des besoins en acides gras à longues chaînes, poly-insaturés (AGLPI). Ils sont en effet incapables de synthétiser des acides gras insaturés (acide eicosapentaénoïque (EPA) et acide docosahexaénoïque DHA) et il faut donc qu'ils les trouvent dans l'alimentation (Kanazawa, 1979). Ces deux acides gras sont donc indispensables au développement des larves et, d'une manière générale, plus le niveau est élevé et meilleure est l'appétence.
3. Le plancton
Le plancton est défini comme l'ensemble des organismes errant au gré des courants. On distingue le phytoplancton et le zooplancton.
On parle de réseau trophique car le phytoplancton, en principe plus petit et autotrophe, constitue le producteur primaire et il est « brouté » par le zooplancton phytophage qui est lui même mangé par le zooplancton zoophage (larves de crustacés, mollusques...).
Les poissons marins ont mis au point différentes stratégies en matière de reproduction qui leur permettent de survivre dans un environnement très concurrentiel. La première est de produire une petite quantité d'œufs qui sont pris en charge par les parents ce qui augmente les chances de survie de l'individu. Les larves pélagiques sont prêtes à se nourrir immédiatement de plancton. Une autre stratégie est de produire un grand nombre d'oeufs et de les distribuer sur de grandes distances. La plupart de ces œufs ne survivent pas mais le nombre d'oeufs produits est alors très important et compense la mortalité. Ainsi, presque tous les poissons marins passent la première étape de leur vie dans le plancton en quête de leur nourriture, le zooplancton.
On distingue plusieurs stades au niveau du développement d'un poisson :
- Le stade larvaire, qui correspond à la période entre l'éclosion et le stade juvénile présentant certaines caractéristiques typiques.
- Le stade juvénile faisant suite à la métamorphose qui peut être un événement rapide ou plus lent selon les espèces et qui induit un changement physique important.
Réussir un élevage nécessite de maitriser la chaine alimentaire, la nutrition est en effet capitale pour le développement des larves de poissons marins. Certaines espèces peuvent être nourries directement aux nauplii d'artémias, toutefois cela ne concerne pas la majorité, bien au contraire. Il faut donc cultiver du phytoplancton ainsi que du zooplancton de taille plus petite que ces nauplii.
4. Le phytoplancton
Le phytoplancton est constitué de diverses algues unicellulaires et microscopiques. Ces algues sont à la base de l'alimentation de certains animaux comme les bivalves filtreurs. Il est présent essentiellement dans les zones superficielles car il utilise la photosynthèse pour se développer. Les radiations lumineuses doivent être favorables à la photosynthèse (jaune). Le phytoplancton correspond à la 1ère étape de la chaîne alimentaire. Toutefois, ce dernier ne sert pas à nourrir directement les larves de poissons mais à développer du zooplancton herbivore (rotifères, copépodes, nauplii d'artémias…). Le phytoplancton est utilisé pour enrichir et faire croître le zooplancton en éléments nutritifs essentiels. En effet, le zooplancton prend la valeur nutritionnelle du phytoplancton qu'il consomme. La valeur nutritionnelle du phytoplancton est donc d'une importance primordiale pour la réussite d'un élevage. Il existe des produits susceptibles de remplacer le phytoplancton afin d'assurer la croissance du zooplancton, mais nos meilleurs résultats ont été obtenus à travers l'utilisation de ces algues unicellulaires.
4.1. Présentation
Il existe un grand nombre d'algues, mais peu d'espèces sont à la fois intéressantes nutritionnellement et avec une croissance aisée. La valeur nutritive de ces micro-algues varie, ce qui rend certaines espèces plus appropriées pour notre usage que d'autres. Les espèces les plus couramment utilisées sont Nannochloropsis oculata, Isochyrsis galbana, Tetraselmis sp.. Dans cette liste nous avons volontairement écarté Chlorella sp. et Dunaniella sp. qui présentent un intérêt moindre au niveau qualitatif.
Les caractéristiques de ces algues varient aussi bien physiquement que qualitativement :
| Algues | Taille | Observations | EPA | DHA | Autres éléments | |
|---|---|---|---|---|---|---|
| Nannochloropsis oculata | 4,2 µm | Flagellé |
Croissance rapide Entretien facile |
Elevé | Faible | Vitamine B12 |
| Isochyrsis galbana | 4-7 µm | Flagellé | Entretien difficile | Faible | Elevé | |
| Tetraselmis sp. | 9-14 µm | Flagellé | Entretien moyen | Moyen | Elevé | Production de composés antibiotiques |
L'utilisation d'un phytoplancton unique est possible pour réaliser une reproduction, toutefois les carences nutritionnelles d'une espèce peuvent être compensées par l'ajout d'une autre espèce. Ainsi Nannochloropsis oculata qui est riche en EPA mais faible en DHA peut être supplémentée par Tetraselmis sp., riche en DHA. Plus on utilisera de souches d'algues différentes et plus les taux de survie des alevins et de croissance seront élevés. Bien-sûr, cela implique des contenants différents pour chacune des espèces. Il n'est pas possible de cultiver plusieurs algues dans le même contenant car une algue sera obligatoirement sélectionnée (la plus compétitive par rapport au milieu). Pour des raisons pratiques, si vous devez n'utiliser qu'une espèce, nous conseillons la Nannochloropsis oculata.
4.2. Les besoins du phytoplancton
Afin de développer ces algues, il existe des paramètres optimaux (Hoff F.H. et al., 1987).
- Aération : Elle est primordiale pour le développement du phytoplancton. Elle favorise les échanges gazeux (apport de CO2), stabilise le pH et empêche la sédimentation des cellules (distribution uniforme des cellules de phytoplancton). On utilise un tuyau semi-rigide opaque sans ajouter de diffuseur car les fines bulles peuvent piéger le phytoplancton au niveau de l'interface air-eau. Le tuyau souple est prolongé par un tuyau rigide de même diamètre qui permet d'atteindre le fond du récipient. Il faut faire attention aux projections d'algues, c'est pourquoi l'utilisation d'une bouteille dont l'encolure est étroite est intéressante. La contamination entre les différentes souches d'algues est très facile et on risque alors d'avoir un mélange verdâtre de différentes algues sans savoir ce que l'on a réellement. De plus, une algue risque de prendre le dessus sur les autres. La formation de mousse traduit souvent le mauvais état de la culture, soit parce qu'elle est trop vieille, soit parce qu'elle est en carence d'un élément. Un repiquage est alors nécessaire.
- Éléments nutritifs : La croissance du phytoplancton dépend des éléments du milieu, dont les macronutriments (carbone, azote, phosphore, silicium, magnésium, potassium et calcium), nécessaires en quantités relativement élevées par rapport aux micronutriments (fer, manganèse, cuivre, zinc, sodium, molybdène, de chlore et de cobalt). Ces éléments sont apportés par l'intermédiaire d'engrais. Le phytoplancton a des besoins élémentaires en nutriments. On peut utiliser de l'engrais pour plante verte type Algoflash fleur. Il est impératif de ne pas surdoser la quantité d'engrais au risque de perdre la culture ou de la polluer par un taux d'ammoniac important ou d'autres nutriments non assimilables. Le dosage utilisé pour le démarrage est de 1ml d'engrais pour 10 litres de culture.
- Lumière : Ces organismes sont autotrophes, ils ont besoin d'un éclairage donnant une intensité de 1000 à 10 000 Lux. Un simple tube horticole est suffisant. Afin d'optimiser la production il faut éclairer sur une photopériode de 16 h. La période sombre de 8 heures est indispensable à la production de protéines. Le temps d'éclairage peut être ajusté en fonction de l'objectif visé : croissance ou maintenance.
- Salinité : Certaines algues tolèrent des variations de salinité, une salinité de 29 est convenable mais par facilité nous utilisons une salinité de 35.
- Température : la tolérance à la température est importante notamment pour la Nannochloropsis : entre 20 et 28 °C.
Certaines algues sont plus tolérantes aux variations du milieu que d'autres (Tableau 2).
| Algues | pH | T °C | Salinité g/l |
|---|---|---|---|
| Nannochloropsis oculata | 7-8,4 | 16-30 | 25 |
| Isochyrsis galbana | 7,8-8,5 | 25-30 | 28 |
| Tetraselmis sp. | 6,9 | 20-28 | 30-40 |
4.3. La culture du phytoplancton
Trouver du phytoplancton est relativement aisé auprès de magasins, de particuliers voire de différents organismes (IFREMER, Aquarium public). Pour les cultiver, on peut utiliser des bouteilles en plastique transparentes. Les bouteilles à parois lisses sont les plus faciles d'entretien. Ces dernières ne doivent servir que pour la culture du phytoplancton.
Il faut tout d'abord verser la culture dans une bouteille (1) en ajoutant de l'eau de mer (2) stérile à bonne salinité et placer la culture à proximité d'une lumière artificielle (3). Le bullage est réglé à environ 10 bulles/seconde pour mettre la culture en suspension. On peut rajouter au dessus un filtre ou un capuchon pour éviter toute contamination. Suivant la quantité d'algues au départ et les paramètres, on va obtenir la plupart du temps une couleur verte (certaines algues peuvent avoir une couleur différente). Le démarrage est souvent un peu long, surtout si vous diluez les algues dans un volume important d'eau. Il faudra être patient, de 5 à 10 jours au début. Une fois la couleur désirée obtenue (4) , il faudra repiquer l'algue (5) et nourrir les proies avec (6). Veiller à remplacer le volume retiré par une quantité d'eau identique et stérile (2) (attention à la salinité). Dans ce cas on profite des changements d'eau sur le bac principal pour l'utiliser dans les cultures. On peut stériliser l'eau soit par filtration mécanique (< 20 µm: à cette taille certains organismes, comme les bactéries, peuvent passer mais ils sont moins enclins à faire disparaître la souche de phytoplancton), soit, par exemple, en passant l'eau quelques minutes au micro-onde. Dans ce dernier cas, il faut attendre que l'eau se refroidisse avant de la mettre dans la culture. On peut également ajouter une goutte d'eau de javel pour éliminer les organismes mais il faudra attendre plusieurs jours avant de pouvoir utiliser cette eau afin que toute la javel s'évapore. Le repiquage de l'algue est une phase importante car le phytoplancton, en se développant, va absorber les éléments nutritifs du milieu et produire des déchets. Ces déchets, au fur et à mesure de la croissance du phytoplancton, vont se concentrer. Après un certain temps, la concentration en déchets va induire une diminution de la croissance de l'algue jusqu'à arriver à la perte de la souche.
Quand vous avez suffisamment de phytoplancton, vous pouvez le récolter et alimenter le zooplancton (7) (rotifères, copépodes, artémias...). Il faut mener en parallèle les cultures de phytoplancton et de zooplancton en veillant à ne pas contaminer le phytoplancton par le zooplancton. Afin d'optimiser au maximum la production en terme de volume, on cultive deux fois plus de phytoplancton que de zooplancton : 2 bouteilles de phytoplancton permettent d'alimenter correctement 1 bouteille de zooplancton. Lorsqu'on a plusieurs bouteilles, il suffit de les identifier, puis, une fois la bouteille arrivée à la couleur désirée, il faut prélever un volume dépendant du temps nécessaire à la culture pour retrouver sa couleur initiale. Par exemple : on peut prélever le 1er jour les 2/3 de la bouteille A et remplacer ce volume par de l'eau stérile, puis le 2ème jour on prélève 2/3 de la bouteille B et ainsi de suite jusqu'à utiliser toutes les bouteilles. Le 1/3 restant de chacune des bouteilles permet de redémarrer la culture assez rapidement. A la fin du premier cycle de prélèvement, on reprend la première bouteille qui a dû se développer suffisamment. Il n'est pas utile de mettre de l'engrais à chaque fois, on en rajoute lorsque la culture a des difficultés à redevenir colorée.
Le zooplancton en consommant le phytoplancton va disposer d'une valeur nutritive semblable aux cellules de phytoplancton. La valeur nutritionnelle du phytoplancton sera donc d'une importance primordiale pour la réussite de l'élevage des larves de poissons.

Il est donc nécessaire de stimuler le niveau nutritionnel du phytoplancton et notamment de jouer sur le niveau d'AGLPI. Le phytoplancton est plus nutritif lorsqu'il est en phase de croissance exponentielle, c'est à dire avant que la culture ne soit saturée. Après cette phase, les cellules entrent dans une période stationnaire et les algues sont beaucoup moins nourrissantes. De plus à concentration élevée, le phytoplancton souffre d'une compétition nutritive vis à vis des macronutriments et des oligoéléments. Les algues libèrent des substances auto-inhibitrices dans le milieu dont l'effet est d'autant plus important que les densités cellulaires sont fortes.
Il est impératif de prélever la culture avant que cette dernière ne soit trop verte et avant de voir une sédimentation au fond de la bouteille. Il faut aussi prendre garde de ne pas avoir un reste d'engrais non utilisé dans la culture, car le taux d'ammoniac influence considérablement la croissance du zooplancton.
Nous utilisons deux algues, la Nannochloropsis sp. du fait de sa facilité d'élevage, et la Tetraselmis sp. pour son apport en d'autres éléments. Ces algues sont utilisées pour cultiver le zooplancton comme les rotifères et certains copépodes. Afin de faciliter le travail et d'éviter des variations brutales, la Nannochloropsis peut être cultivée à la même salinité que le zooplancton.


Il est difficile de maintenir la stérilité, notamment lorsqu'on utilise des aquariums pour la production en grande quantité. Cette stérilité exige que le récipient soit exempt de toute forme de vie. Pour nos besoins, on pourra assouplir cette contrainte car on a souvent des contaminations par différents organismes (bactéries …) qui ne provoquent pas pour autant la disparition de l'algue. On doit toutefois absolument éviter les prédateurs strictement phytophages dans les cultures d'algues au risque de voir disparaître la souche : une contamination par des rotifères va décimer très rapidement la culture de phytoplancton. Il y a donc quelques règles de base à respecter :
- Cultiver le phytoplancton et les rotifères dans deux salles différentes, si possible, sinon toujours disposer le phytoplancton au-dessus des rotifères.
- Conserver un matériel propre et irréprochable, utiliser un équipement spécifique pour le phytoplancton en l'identifiant.
- Utilisation de bouteilles en plastique aseptisées, quitte à en changer, les rincer avec de l'eau propre et les laisser sécher la tête en bas.
- Il faut être soigneux et privilégier un protocole de maintenance des souches (travailler le phytoplancton avant le zooplancton).
Le cycle de croissance a un impact important sur la qualité du phytoplancton. On doit veiller à le récolter lorsqu'il est en phase de croissance exponentielle et non en état stationnaire. C'est en effet pendant cette période que les algues prélèvent un maximum d'éléments nutritifs et qu'elles sont qualitativement plus intéressantes.
L'utilisation de l'engrais traditionnel présente des inconvénients notamment au niveau des teneurs en nutriments. En effet, certains engrais qui n'ont pas une composition chimique permettant une assimilation complète de tous les éléments peuvent s'accumuler dans l'eau. C'est pourquoi un milieu spécifiquement utilisable pour la croissance du phytoplancton a été développé. Ce milieu, dit milieu de Conway, est utilisé pour enrichir l'eau de mer naturelle et convient à toutes les espèces de phytoplancton.
Milieu de Conway : (Audineau, Blancheton - 1985-1986)
| Nom usuel | Formule brute | Quantité |
|---|---|---|
| Chlorure de Zinc | ZnCl2 | 2,10 g |
| Chlorure de Cobalt | CoCl2 6H20 | 2,00 g |
| Ammonium heptamolybdate | 6(NH4) Mo7 O24 4H20 | 0,90 g |
| Sulfate de Cuivre | Cu SO4 5H2O | 2,00 g |
| Eau distillée | 100 ml |
| Nom usuel | Formule brute | Quantité |
|---|---|---|
| EDTA Disodique | Na2 EDTA | 45,0 g |
| Nitrate de sodium | Na NO3 | 100,0 g |
| Acide Orthoborique | H3BO3 | 33,6 g |
| Dihydrogénophosphate de sodium | NaH2PO4 | 20,0 g |
| Chlorure de manganèse | MnCl2 4H2O | 0,4 g |
| Chlorure ferrique> | FeCl3 H2O | 1,3 g |
| Solution de traces de métaux | 1 ml | |
| Eau distillée : qsp | 1 l |
| Nom usuel | Quantité |
|---|---|
| Thiamine Chlorhydrate | 200 mg |
| Vitamine B12 | 10 mg |
| Nom usuel | Quantité |
|---|---|
| Solution principale | 1 ml |
| Solution vitaminique | 0.1 ml |
5. Le zooplancton
Il faut considérer le phytoplancton comme étant le carburant du zooplancton, lui-même étant le carburant des larves de poissons. C'est à partir du zooplancton que les larves de poissons vont pouvoir se développer. Pour l'élevage des poissons d'eau de mer, on va utiliser principalement trois grands groupes d'organismes marins appartenant au zooplancton : les rotifères, les copépodes et les artémias.
5.1. Les rotifères
Le phylum (ou embranchement) des rotifères se compose de 3 classes, 120 genres et environ 2000 espèces. Les rotifères sont principalement d'eau saumâtre ou d'eau douce et ils ne sont donc pas une proie naturelle pour les poissons marins. Les espèces Brachionus plicatilis (200-300 µm) et Brachionus rotundiformis (80-120 µm) (Pourriot R., 1980) sont les plus utilisées pour l'élevage des poissons marins.
Les rotifères disposent de caractéristiques intéressantes au niveau de la prédation par les alevins comme leur petites tailles, leur digestibilité, leur déplacement relativement lent et le fait qu'ils restent en suspension dans la colonne d'eau. Les rotifères sont de plus des organismes qui peuvent être facilement cultivés en grand nombre et rapidement. Ils ont toutefois une valeur nutritive faible, il faut visualiser ces organismes comme de petits sacs à remplir. Lorsqu'on les enrichit, ils jouent le rôle de bio-transporteurs, notamment au niveau des acides gras essentiels (EPA / DHA).
5.1.1. Présentation
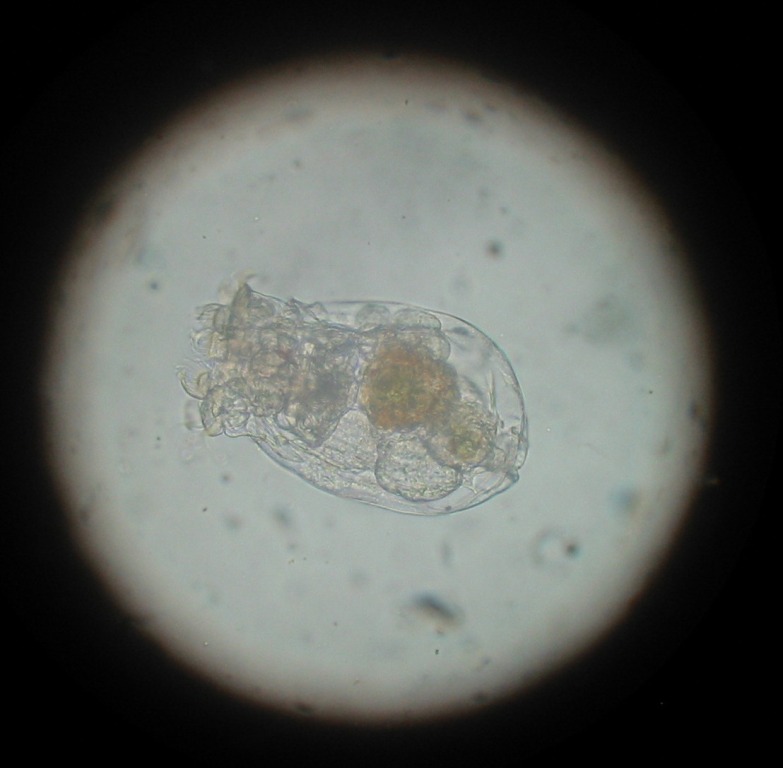
Les rotifères et notamment le genre Brachionus, sont les organismes les plus utilisés comme premier aliment. Ainsi, Brachionus plicatilis qui appartient à la famille des Brachionidae, est de taille adéquate pour de nombreuses larves de poissons marins tels que les poissons-clowns.
Avant de pouvoir cultiver cet organisme il est indispensable de connaître son mode de vie. B. plicatilis est une espèce polyphage de type filtreur. Il peut se nourrir d'algues, de bactéries et de levures. Il est capable d'ingérer des particules de 12 à 15 µm. Les rotifères disposent d'un organe cilié sur la tête qui permet la capture des aliments. Ils peuvent se fixer par l'intermédiaire d'un pied. Leur cycle de vie alterne la reproduction sexuée et asexuée suivant les conditions de milieu.
Les Brachionus adultes engendrent entre 1 et 4 œufs desquels naît un jeune complètement formé. Le principal mode de reproduction des rotifères est la parthénogenèse, c'est à dire une reproduction asexuée. Lorsque les conditions environnementales sont bonnes, ils peuvent produire jusqu'à 7 œufs en même temps. Les rotifères éclosent au bout de 12 heures et sont sexuellement matures 18 heures plus tard. Les œufs sont produits en grande quantité pendant les deux premiers jours, la fertilité baissant par la suite. Leur durée de vie est de 6 à 8 jours pour les femelles et de 2 jours pour les mâles à 25°C. La connaissance du cycle biologique va conditionner l'élevage de cet organisme. Comme on le verra plus tard, afin d'éviter d'avoir des rotifères âgés, et donc non productifs, il faudra changer au moins 25 % du volume d'eau chaque jour.
Dans des conditions optimales de culture, le taux de reproduction est élevé : la population peut doubler en 24 heures. Toutefois, les rotifères ont un métabolisme très élevé et dans le cas d'une densité trop forte ils peuvent rapidement épuiser l'oxygène dans l'eau (Ruttner & Kolisko, 1974).
Ils sont capables de s'adapter à de fortes variations de milieu (température, salinité) et sont donc des organismes faciles à élever. On peut utiliser pour l'élevage soit du phytoplancton soit des éléments artificiels (Selco, Rotirich…). Lorsque les conditions sont défavorables, les rotifères se développent par reproduction sexuée. Les femelles amictiques (parthénogenèse) donnent naissance à des femelles dénommées mictiques car elles donnent naissance à des mâles. Les mâles fécondent alors les femelles mictiques et le processus de reproduction sexuée peut commencer. Les œufs fécondés appelés kystes ont des formes de résistances pouvant donner un individu lorsque les conditions du milieu seront redevenus favorables (Hoff, 1987).
Les rotifères du genre Brachionus sont classés par "Type" en fonction de différentes caractéristiques morphologiques comme la forme du pied, l'aspect des rebords de la lorica (enveloppe dure qui protège le corps de l'animal) et la taille de l'individu. Plusieurs sous-espèces ont été répertoriées, dont deux variétés génétiquement différentes sont exploitées :
- Type L : Brachionus plicatilis hepatotomus (appelé aussi Brachionus plicatilis typicus) dont la longueur varie entre 130 µm et 340 µm mais avec une moyenne de 240 µm
- Type S : Brachionus plicatilis rotundiformis qui mesure entre 100 et 210 µm (moyenne de 160 µm)
- Type SS : issu du type S mais encore plus petit (de 100 à 120 µm), il permet de nourrir des alevins de très petites tailles.
Il existe un large éventail de tailles dans chacune des souches L, S et SS. Par exemple, de nombreuses souches L se situent dans la gamme de 200 à 300 µm, mais certaines exploitations sont arrivées a sélectionner des souches L de 160 µm qui sont, du coup, plus petites que certaines souches S. La taille est parfois difficile à mesurer car les Types S et SS sont rondes alors que les souches L sont oblongues.
Les besoins de ces sous-espèces sont différents, les premiers sont eurythermes (organisme adapté à de grandes variations de température) bien qu'il préfèrent les températures basses (croissance maximum à 25 °C) alors que les seconds sont sténothermes (organisme supportant faiblement les variations de température) et plutôt thermophiles (croissance maximum 34 °C).
5.1.2. Les besoins des rotifères
Besoins de Brachionus plicatilis (Hoff F.H. et al., 1987) :
- Température : elle doit être maintenue entre 20 et 25 °C (maximum 27 °C). Dans une pièce à température normale, il est inutile d'ajouter un chauffage. Comme indiqué précédemment, la plage de variation est large. Toutefois, le métabolisme est étroitement lié à la température : plus la température est élevée et plus le taux de multiplication le sera. Mais, plus la température est élevée et plus le milieu est instable. Les bactéries vont se développer plus vite, au risque d'éliminer la culture par pollution du milieu. A température ambiante, l'élevage est relativement sûr. Pour les souches petites de type S ou SS, la plage de la température idéale est supérieure. Dans tous les cas, il est important d'éviter des fluctuations de température brutales. Lors des température froides, ils entrent en hibernation.
- Densité : l'optimum pour notre usage est de 1014. B. plicatilis vit dans l'eau saumâtre et peut très bien se développer à une densité de 1007. Toutefois, lorsqu'on va l'introduire dans le bac d'élevage, le choc osmotique sera tel qu'il va tomber au sol sans être prélevé par les larves. Lorsque la salinité augmente, les rotifères produisent plus de mâles afin de favoriser la reproduction sexuée. Les rotifères se reproduisent plus vite lorsque la salinité est basse.
- Lumière : les rotifères sont photophiles et attirés par la lumière. La lumière joue un rôle physiologique dans la reprise de l'activité car le passage de l'obscurité à la lumière provoque une éclosion des œufs. Toutefois, il n'est pas utile d'éclairer la culture, la lumière du jour est suffisante.
- Alimentation : les rotifères ne sont nutritifs et appétants que s'ils sont nourris avec certains aliments. Ils doivent constamment avoir de la nourriture, le mieux étant de leur en procurer deux fois par jour. A la base, cette nourriture est constituée par le phytoplancton (Nanochloropsis, Tetraselmis…). Etant filtreur, cet organisme peut également se nourrir de bactéries, de levures et il accepte la nourriture inerte. Les vitamines B12 et A sont nécessaires au développement des rotifères et doivent être rajoutées si on n'utilise que des aliments secs.
- pH : l'optimum de développement se situe sur une plage très large entre 7 et 9. Une culture âgée aura un pH bas. Il est préférable de maintenir les rotifères à un pH relativement identique au bac d'élevage, le pH optimum est de 8.
- Ammoniac : les rotifères sont sensibles à l'ammoniac. Une faible concentration peut très vite engendrer une baisse du développement voire une mortalité accrue. En récoltant 25 % du volume de la culture par jour et en renouvelant cette eau, cela suffit à limiter des concentrations hautes en ammoniac. Bien-sûr, le renouvellement de cette eau se fait avec adjonction de nourriture (algues, produits…) pour que la croissance des rotifères ne s'arrête pas. On siphonne les détritus au fond tous les trois à quatre jours (risque de développement bactérien).
5.1.3. La culture des rotifères
Il existe plusieurs méthodes de culture de ce rotifère (Lee C.S. et al., 1985). Celle-ci peut se faire sous forme de batch ou selon une méthode dite continue. La méthode décrite ci-dessous présente celle que nous utilisons c'est à dire sous forme de batch (Lavens, P., Sorgeloos, P., 1996). A partir d'une souche de rotifères (B. plicatilis) de quelques individus, on peut obtenir rapidement une population importante :
- Introduction d'une souche d'algue, bien verte, sans ammoniac, dans un petit volume (bouteille de 1 à 2 litres) d'eau de mer de faible densité (1014).
- Aération de la culture par bullage. Ne pas mettre de diffuseur car cela favorise la formation de mousse en surface. On insère un tube rigide au bout du tuyau souple de la pompe à air pour remuer toute la culture.
- Une fois le liquide devenu transparent (selon les conditions du milieu après 48 heures), la culture est placée dans un seau de 20 litres contenant de l'algue en phase de croissance. La salinité doit être identique à la culture de base. Des souches d'algues sont préservées au réfrigérateur afin de pallier à d'éventuelles contaminations. Ces dernières devront, elles aussi, être repiquées régulièrement, tous les mois par exemple.
- C'est dans les seaux que nous enrichissons les rotifères. Le mieux est de les nourrir deux fois par jour par doses assez faibles. Il est indispensable d'alimenter en permanence afin de garder une population maximale.
- Les rotifères seront récoltés tous les jours en utilisant des tamis. Pour notre part, nous utilisons des tamis de 125 µm et de 60 µm pour la récolte. Suivant les besoins, le prélèvement est de 50 à 75 % du volume de la culture, remplacé par le même volume d'algues à la même densité. Ainsi, avec une source quotidienne d'algues à concentration constante, on ajoute à la population restante de rotifères, la nourriture nécessaire à 24 heures de croissance. Du fait d'un prélèvement journalier, l'évaporation n'a pas d'influence sur la culture. Il n'y a pas de changement d'eau à proprement parler, il est obtenu lors du prélèvement et par le remplacement par de l'algue en culture.
- La culture des rotifères produit des quantités importantes de déchets et il est souvent difficile de maintenir une qualité d'eau optimale. Après quelques jours, l'accumulation de détritus au fond du seau, favorise le développement bactérien. Il est donc nécessaire de les retirer tous les 3 ou 4 jours.
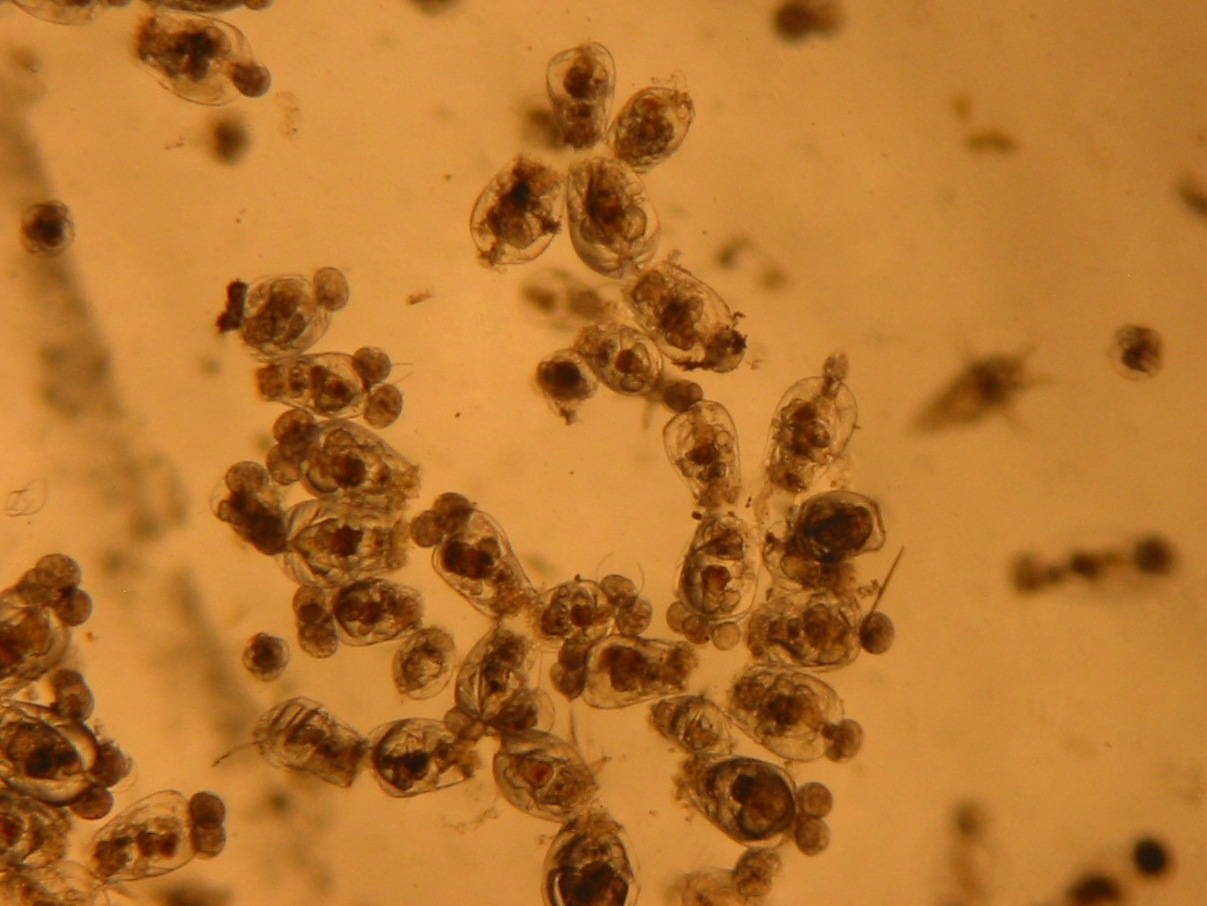
Cette technique permet de maintenir aussi bien les algues que les rotifères en état de croissance, ce qui évite des problèmes : la culture sous algues est toujours plus propre et dynamique. Conserver une population jeune, constamment en renouvellement, est gage de réussite. Toutefois, les seaux d'élevage de rotifères doivent être nettoyés régulièrement car il y a une accumulation sur les parois des algues non consommées par les rotifères. Cette couche est propice au développement de ciliés et de bactéries qui induisent une production moindre de rotifères.
Certaines variations brutales de paramètres peuvent également engendrer une forte diminution de la croissance des rotifères, voire un crash de la culture. Les plus fréquentes sont les changements de température, de pH (avec un pH trop haut l'ammoniac devient toxique), de salinité qui peuvent survenir lorsqu'on introduit de fortes quantités d'algues. De même des niveaux de polluants trop élevés, du fait d'excès d'engrais, nuisent considérablement à la production de rotifères.
Le repiquage des cultures est un point important. La culture atteint son apogée à un certain moment. On filtre alors la culture, lorsque le nombre d'individus se situe entre 100 et 1000 par ml. L'erreur est de croire que l'on va pouvoir maintenir cette forte proportion mais cette étape précède la chute brutale de la population. Non seulement pour des questions nutritives mais aussi en terme de production, il faut toujours être en mouvement, c'est à dire repiquer les cultures sans cesse, quitte à jeter le surplus de nourriture (quand on dit jeter il est bien évident que l'on peut distribuer ces rotifères dans un aquarium communautaire…).
5.1.4. L'enrichissement
Les rotifères n'offrent qu'une faible valeur nutritive s'ils ne sont pas enrichis. Ces animaux sont très voraces et le but est d'enrichir les rotifères avec des acides gras, des éléments nutritifs et des vitamines, afin de garantir une bonne croissance aux larves de poissons. Les acides gras hautement insaturés sont d'une grande importance à la survie des larves. Pour cela, nous disposons de différents moyens et méthodes. Les algues contiennent ces éléments nutritifs comme nous l'avons vu, mais de nombreux produits inertes existent aussi pour enrichir les rotifères (Seychelles, L sous presse).
Afin d'obtenir une bonne production, nous utilisons un mélange de Nannochloropsis sp. et de Tetraselmis sp. La Nannochloropsis sp. permet de conserver une production élevée de rotifères. En ajoutant de la Tetraselmis sp. le taux de reproduction augmente encore. En terme de volume, lors de la culture de rotifères, 4/5 du volume est constitué par de la Nannochloropsis sp. et 1/5 par de la Tetraselmis sp. Afin d'augmenter la teneur en oméga 3 (DHA), on peut rajouter une autre algue comme Isochrisys sp. Cette dernière algue apporte un complément intéressant. En raison des difficultés à la produire et pour ne pas multiplier les cultures nous utilisons des additifs spécifiques utilisés dans l'élevage larvaire. Il faut être extrêmement prudent avec le dosage de ces ingrédients car, si on à la main trop lourde, on peut tuer les rotifères et favoriser le développement de bactéries. Dès que la culture est un peu plus claire, on peut redonner de la nourriture. Il est ensuite aisé d'adapter la dose à la population présente. Selon les données du fabricant, les rotifères nécessitent de 8 à 12 heures pour être enrichis (le maximum de la population).
La phase d'enrichissement est une phase très importante car elle conditionne le développement larvaire et surtout l'appétence des proies. Les larves vont choisir les proies et préféreront mourir si les rotifères sont vides. De même la qualité nutritionnelle conditionne le bon développement larvaire. Par exemple, les clowns (A. ocellaris) qui n'ont pas des bandes complètes ont souvent eu un développement larvaire moins bon du fait d'un manque de nourriture de qualité.
Il est difficile de donner des dosages car cela dépend de nombreux facteurs, notamment la température, le stade de développement de la culture... En principe, quelques gouttes suffisent pour un seau de 20 litres. De nombreux produits existent : Selco, Algamax, Rotigrow... On peut utiliser également du phytoplancton en poudre comme de la spiruline ou en pâte : cryopâtes. De même, il est possible de faire absorber aux alevins, par l'intermédiaire des rotifères, des aliments ciblés comme des médicaments (antibiotiques).
5.1.5. Les alternatives à l'utilisation du phytoplancton vivant
On peut se poser la question de la possibilité d'élever des larves de poissons sans utiliser tout un système de culture d'algues. Par manque de place, de temps, il existe des alternatives à la fabrication personnelle de phytoplancton :
- Le phytoplancton cryoconservé : des sociétés proposent des solutions concentrées de phytoplanctons, soit seules, soit en mélange et avec leur analyse en éléments nutritifs. Ce mélange fournit tout ce dont ont besoin les larves pour se développer et peut être conservé pendant une période de un an (Inland Inc Seafarms, Reed mariculture). Ce phytoplancton est mort et donc pollue plus facilement le bac de culture du zooplancton. De plus, le prix peut être un frein, surtout pour les simples amateurs dont l'objectif principal n'est pas de faire du volume.
- La pâte d'algue (Reed mariculture) : des sociétés proposent également des algues concentrées sous forme de gel liquide. Les cellules ne sont pas vivantes car elles ont été congelées. Son utilisation peut être problématique car les cellules ont été cassées par le froid et tout le contenu des cellules est déversé dans le milieu. Les bactéries peuvent alors rapidement se développer aux dépens du zooplancton.
- Utilisation d'une micro-algue marine Schizochytrium sp. séchée par pulvérisation. Des produits à base de cette algue peuvent être utilisés comme un substitut alimentaire (Alagamac et Rotimac de Aquafauna marine Inc.) pour enrichir les rotifères. Ces produits sont très riches en EPA et DHA. Un de leurs gros avantages est la possibilité de les doser avec exactitude et de les utiliser dans le bac d'élevage larvaire.
- L'huile de poisson peut être également utilisée. Ces produits peuvent être sous forme liquide ou solide (poudre). Ils ont des valeurs élevées en acides gras (Selco, RotiRich…). Nous utilisons certains de ces produits en complément des algues 12 heures avant le prélèvement des rotifères, pour finir l'enrichissement. Ces produits sont toutefois très pollueurs et il ne faut jamais les mettre directement dans le bac d'élevage. De même, lors de l'enrichissement de la culture de rotifères, il faut faire extrêmement attention au dosage car ils peuvent engendrer un développement bactérien.
- La levure peut être également utilisée pour développer les rotifères. Elle doit être bien diluée dans de l'eau afin de ne pas provoquer une pollution accrue et un développement bactérien. Mais les rotifères qui sont alimentés exclusivement de levure sont déficients en acides gras et leur valeur nutritionnelle est insuffisante.
Malgré sa petite taille, le rotifère est parfois encore trop grand pour certains types d'alevins comme Centropyge sp. Toutefois, les rotifères mâles sont plus petits que les femelles et certains ne dépassent pas 60 µm. Ainsi, si on favorise la reproduction sexuée dans des conditions de milieu difficile, on peut favoriser la production de mâles. L'inconvénient c'est que les mâles ont une durée de vie courte et il est très difficile de les enrichir. Il faudra donc les utiliser comme une pré-étape courte d'alimentation des alevins. De même, on peut sélectionner le morphotype suivant la température : des températures hautes (28 – 35°C) favorisent la croissance du Type S et des températures plus basses (23 – 28°C) favorisent le Type L. Enfin, le type d'alimentation influence également la taille des rotifères : la levure de boulanger (haute teneur en protéines) permet d'obtenir des individus de plus grande taille.
Quel est l'intérêt de cultiver des micro-algues pour l'enrichissement, avec le travail que cela implique, lorsque des formulations en poudre peuvent être utilisées ?
Comme on peut le voir il existe de nombreuses alternatives à l'utilisation du phytoplancton vivant mais il faut rester très prudent quant à l'utilisation de ces produits. Il est difficile de donner un dosage précis pour tel ou tel produit car il est dépendant des conditions du milieu et de la population en rotifères. On peut par exemple cultiver les rotifères avec de la spiruline en poudre puis enrichir avec des produits comme de l'Algamac ou d'autres produits présents sur le marché.
Dans notre cas, nous avons toujours cultivé notre phytoplancton. Le phytoplancton vivant permet, en plus de nourrir le zooplancton, de maintenir une culture saine en limitant la pollution. Mais il ne faut pas négliger l'utilisation des produits annexes qui apportent un plus au niveau de l'enrichissement du zooplancton. En effet, l'abondance et la qualité du zooplancton dépend de sa nutrition. La Nannochloropsis sp. est carencée en une substance nutritive importante : les oméga-3 (acide gras DHA). C'est pour cela qu'il faut compléter avec un élément riche en oméga-3 lors de la phase d'enrichissement. La combinaison de ces substances induira de grandes quantités de rotifères enrichis en fournissant un profil nutritionnel idéal pour les larves.
| Phytoplancton vivant | Nourriture inerte | |
|---|---|---|
| Avantages |
- aide à maintenir la qualité de l'eau (gestion de l'ammoniac) - facilité à cultiver - bon marché |
- facilité de stockage - pas d'éclairage - pas de cultures supplémentaires - concentration des produits - enrichissement en différents éléments |
| Inconvénients |
- besoin de lumière - place supplémentaire - difficulté à concentrer |
- plus onéreux - développement accru de bactéries - risque de modification du milieu (pollution) |
Enfin, on n'a pas toujours d'élevage en cours et il est possible de mettre les rotifères en hibernation. On peut introduire les rotifères dans une bouteille remplie à moitié de phytoplancton et placée dans le réfrigérateur, les rotifères entrent alors dans une sorte de dormance. La culture peut être réutilisée quelques semaines plus tard.
5.2. Les copépodes
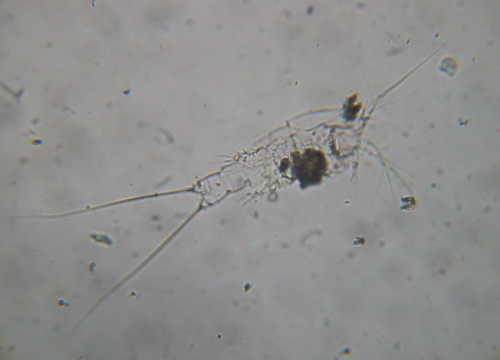
L'utilisation des copépodes pour la reproduction de certaines espèces marines est un plus par rapport aux rotifères. Il est tout à fait réalisable de reproduire des poissons-clowns avec seulement des rotifères et passer ensuite directement au nauplii d'artémias. Par contre, pour certaines espèces, le passage aux copépodes est déterminant voire indispensable (Hippocampus reidi).
Les larves de poissons marins sont régulièrement confrontées aux copépodes à l'état sauvage et de nombreuses espèces sont adaptées pour digérer ces organismes. En raison de l'abondance des populations, de la taille et de la valeur nutritionnelle, les copépodes sont les principaux aliments pour de nombreuses espèces marines (Lee et al. 2005).
Dans le milieu naturel, les copépodes sont la deuxième source de protéines après le krill. Ils constituent la nourriture des premiers stades de vie des poissons marins. Ainsi, les stratégies de reproduction des poissons ont évolué en fonction du développement des populations de copépodes comme aliment de base. La culture de copépodes va donc nous apporter une contribution importante dans la réussite du développement des larves. La gamme de taille de 100 µm pour les nauplii à 1 mm pour les adultes correspond à la taille que peut ingérer les alevins. De plus, les copépodes disposent de niveaux naturellement élevés en acides gras essentiels Dans ce cas pourquoi utiliser des rotifères à la place des copépodes ? L'une des réponses est que la vitesse de multiplication des copépodes est beaucoup plus faible que celle des rotifères et la culture de copépodes demande des volumes plus importants.
5.2.1. Présentation
Les copépodes appartiennent à la classe des crustacés et on les trouve à la fois dans les eaux douces et dans les milieux marins.
Environ 12 000 espèces ont été décrites à ce jour, que l'on retrouve dans de nombreuses niches différentes. Les copépodes forment un groupe très diversifié au niveau du comportement et de l'habitat : certains sont parasites, d'autres phytophages ou détritivores. Le plancton marin comprend huit des neufs ordres de ce groupe (Razouls C. et al, 2005-2011). Nous allons nous intéresser à deux groupes principaux de copépodes libres : les Calanoïda : animaux pélagiques (nage libre) et les Harpacticoïda qui sont entièrement benthiques (sur le fond).
Mais pourquoi vouloir identifier à tout prix ces animaux ? Ne peut-on pas faire une simple culture d'un copépode pour nos reproductions ? L'identification de ces animaux est indispensable car cela va nous permettre de connaître leur besoin alimentaire et ce que l'on peut attendre comme production. De même, comme on le verra par la suite, leur comportement et leur mode de vie sont primordiaux pour l'élevage de certaines larves de poissons. La connaissance de ce groupe nous permettra donc d'améliorer la production de la culture et surtout de choisir la meilleure espèce selon ses besoins.
Morphologie
Les copépodes disposent des caractéristiques suivantes : 2 paires d'antennes, 3 paires de vraies pattes, et des pattes sur l'abdomen. Tous ont des stades dits « nauplius » (5 ou 6 stades selon les espèces) et 5 stades « copépodites ». Le stade copépodite ressemble à celui des adultes, la métamorphose ayant lieu au dernier stade nauplius.
Cycle biologique
Le cycle biologique varie en fonction de l'espèce mais cela prend entre 30 et 45 jours pour aller de l'œuf à l'état adulte et à la production des œufs.
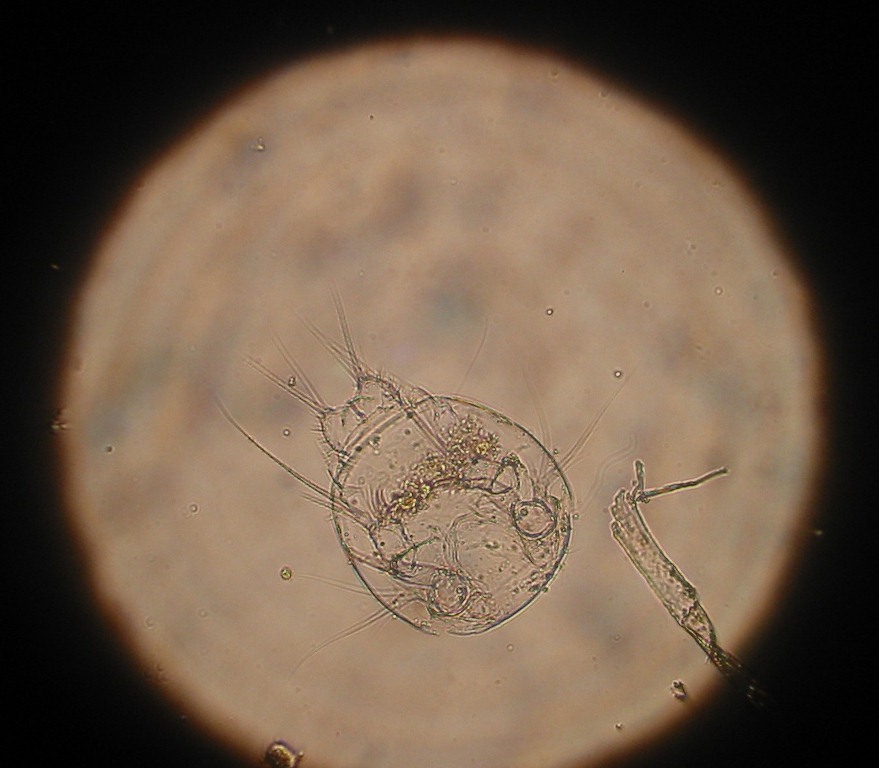
Les larves appelées nauplius représentent la nourriture adaptée pour les larves des poissons et des crustacés. En effet, à ce stade, ce groupe a la taille, la forme, les mouvements et les éléments nutritifs pour le rendre très intéressant pour la croissance des premiers stades larvaires des alevins. Dans le milieu naturel, les copépodes jouent un rôle prépondérant dans l'alimentation des larves de poissons.
Les œufs fécondés sont détenus par la femelle dans des genres de sacs. Le premier stade, dit stade Nauplius, a une croissance rapide. Après 6 métamorphoses successives, la larve se transforme en copépodite qui ressemble à l'adulte. L'animal va changer de stade avec en parallèle une augmentation du nombre de pattes natatoires. Comme pour les autres crustacés, ce changement de stade se fait par des mues successives. Le développement des copépodes est dépendant de la température et, à 25 °C, il faut compter 10 à 12 jours pour arriver au stade adulte. Le stade Nauplius est attiré par la lumière. Les adultes ont un mouvement saccadé et offrent des trajectoires en zigzag ce qui influe très certainement sur l'attraction des prédateurs éventuels.
5.2.2. Conditions de vie
L'avantage des copépodes est qu'ils supportent des variations de la salinité (25 à 40) et de la température (de 6 °C à plus de 35 °C) importantes, tant qu'elles sont progressives. De plus, ils tolèrent des périodes sans alimentation en vivant sur leur réserve. Toutefois, afin qu'ils soient productifs et nutritifs, il vaut mieux les cultiver dans de bonnes conditions.
5.2.3. La valeur nutritive
La qualité nutritionnelle des copépodes est reconnue comme étant très bonne pour les larves de poissons. Les copépodes disposent d'une teneur élevée en protéines avec un bon profil en acides aminés (constituants des protéines). Seul deux acides aminés sont absents, la méthionine et l'histidine. De plus, les copépodes disposent naturellement d'une teneur élevée en acides gras. Ces acides gras sont produits par le phytoplancton et les copépodes sont capables de les concentrer. Certains copépodes sont plus riches que d'autres en acides gras et cela peut également dépendre du mode d'alimentation. Ainsi les copépodes prédateurs de rotifères, de ciliés ou de bactéries ont une plus grande proportion d'acides gras que ceux qui se nourrissent de phytoplancton. Ils contiennent une proportion d'acides gras qui dépasse celle des rotifères enrichis ou des artémias enrichis (Sargent et al. 1997). Enfin ils offrent aux larves de poissons qui possèdent un système digestif peu développé un apport d'enzymes intéressant. De plus, la qualité nutritive de la proie joue un rôle important sur l'appétence. Bref, cela constitue un « produit alimentaire » intéressant pour l'aquariophile amateur. Toutefois, il existe des variations nutritives entre les différents groupes (Sazhina, 1987).
5.2.4. Différenciation des copépodes
Il existe une règle générale pour différencier facilement les grands groupes de copépodes. Les harpatacoïdes disposent d'antennes courtes contrairement aux calanoïdes. Les antennes des cyclopoïdes sont intermédiaires. Les cyclopoïdes disposent de deux sacs d'œufs alors que les calanoïdes n'en ont qu'un.
Les harpacticoïdes

les copépodes appartenant à l'ordre harpacticoida sont benthiques, les adultes et les nauplii se trouvent principalement sur le substrat, les roches et les vitres. Ils se nourrissent de restes d'aliments (détritivores) ainsi que d'algues. Ils sont plus petits que les calanoïdes. On les retrouve dans les aquariums car ils restent une partie du temps sur le substrat. Ce groupe de copépodes est très rustique et accepte des variations de ses conditions de maintenance. On trouve dans ce groupe le genre Tisbe (Tisbe furcata) et le genre Trigriopus (Tigriopus brevicornis). Ce groupe est facile à reconnaître car il dispose d'une première antenne très courte et d'une deuxième antenne courte également et biramée.
Les espèces de ce groupe présentent des avantages par rapport au groupe des calanoïdes :
- Fécondation élevée et cycle de vie plus court,
- tolérance importante aux variations du milieu,
- adaptation à plusieurs formes d'alimentation (broyats de paillettes, algues, levures…),
- possibilité d'atteindre des densités élevées (pour des copépodes).

Les difficultés rencontrées lors de sa culture sont liées au substrat, puisque cette espèce est benthique. L'élevage mixte est possible entre les rotifères et certaines espèces de copépodes (Tigriopus brevicornis). Il est possible, suivant l'aliment apporté, de favoriser un type de population. La concentration des élevages est directement liée à la quantité de nourriture offerte par l'apport quotidien. Ils sont détritivores. Dans notre élevage, ils sont nourris aux paillettes finement broyées avec un ajout d'algues (Nannochloropsis sp. et Tetraselmis sp.). Les nauplii de ces copépodes sont par contre pélagiques.
L'inconvénient majeur de ce groupe est que les adultes sont benthiques et les larves de la majorité des poissons n'arrivent pas à les attraper lorsqu'ils sont collés sur le substrat. Toutefois, par expérience, les larves d'hippocampes (Hippocampus reidi) arrivent parfaitement à attraper ces proies dès les premiers jours. On peut également penser que les larves de Synchiropus sp., après passage aux rotifères, peuvent les chasser facilement. Certaines espèces du genre Tigriopus sont carnivores, le genre Tisbe est plus détritivore mais les deux peuvent être cannibales. Toutefois une espèce Acutifrons euterpina, qui fait partie du groupe des harpaticoïdes, est une espèce très petite et difficile à élever et n'est pas benthique. L'élevage de cette espèce est une piste très intéressante pour la reproduction de poissons dont les larves sont très petites (Centropyge sp.).
Les calanoïdes

Les calanoïdes sont des organismes pélagiques qui constituent principalement la biomasse océanique du plancton. Les copépodes appartenant à l'ordre calanoida tels que Acartia sp. (Acartia tonsa) se reconnaissent par de grandes antennes et restent dans la colonne d'eau aussi bien au niveau des adultes que des nauplii. De ce fait, ces derniers ne sont pas présents dans les aquariums récifaux éliminés par la filtration. Les calanoïdes ont un cycle de vie relativement court approximativement de 20 à 30 jours. Les copépodes calanoïdes ont des exigences élevées sur la nourriture et ils sont plus difficiles à élever (Klein Breteler W. C.M., 1980). Les calanoides consomment principalement le phytoplancton et les protozoaires (Jonsson R. et al., 1990). Toutefois, certains genres sont carnivores avec du coup une modification importante des pièces buccales et du mode d'alimentation. Enfin, certaines espèces sont très tolérantes en terme de température et de salinité (A. tonsa). Les adultes mesurent environ 1,5 mm de longueur, et leurs nauplii au stade N1 font environ 70 µm de longueur. À 25 °C, la plupart des oeufs éclosent dans les 48 h. Les femelles de A. tonsa produisent en moyenne entre 20 et 50 œufs par couvée tous les 5 à 6 jours. Ce copépode se nourrit de phytoplancton mais consomme aussi des ciliés et des rotifères (Mauchline, J., 1998). Il a un cycle de vie court d'environ 9 jours, et une bonne production. A. tonsa est un copépode assez petit, adapté à la plupart des larves de petite taille. Enfin, les calanoïdes sont exigeants en terme de densité de population. Ils sont aussi cannibales et se nourrissent de leur propre nauplii (Pearson-Le Ruyet, 1975).
Les cyclopoïdes
Les copépodes de l'ordre cyclopoida, comme par exemple les genres Oithona et Paracyclops, sont un croisement entre les deux autres ordres. Certaines espèces sont de meilleure qualité mais difficiles à cultiver. Par contre, cet ordre comprend un grand nombre d'espèces parasites et doit donc être cultivé avec prudence. N'ayant pas d'expérience sur cet ordre, je ne donnerai pas plus de détails.
5.3 La culture de copépodes
Nous travaillons essentiellement sur Nannochloropsis sp. et sur Tetraselmis sp. pour favoriser le développement des copépodes. L'apport de nourriture est dépendant des besoins. Par exemple, lors de l'élevage d'hippocampes (Hippocampus reidi), la demande est énorme en copépodes et il faut pour cela disposer d'un volume suffisant et nourrir tous les jours la culture sans la polluer. Même si les espèces de copépodes cultivées ne sont pas toutes des herbivores stricts, une nourriture végétale leur est administrée. L'utilisation de phytoplancton vivant contribue également à la stabilisation du milieu. Afin d'entretenir une production massive, un broyat fin de paillettes pour poisson est incorporé dans le bac de production tous les jours. Cette quantité de nourriture doit être adaptée à la population et aux conditions abiotiques du milieu lorsqu'on est par exemple dépendant de la température (si le bac se situe à l'extérieur).

L'utilisation, pour un élevage, d'une concentration importante de nourriture devient néfaste si les changements d'eau sont insuffisants. Les algues ont parfois tendance à se fixer sur les parois ou à sédimenter et finalement la quantité d'algues peut devenir insuffisante. C'est pourquoi un bullage important est réalisé aux deux extrémités du bac. De nombreux déchets, cadavres d'animaux, s'accumulent dans les bacs d'élevage et provoquent une pollution du milieu. Sans changement d'eau, on assiste à un développement de ciliés sur les cadavres de copépodes et ces derniers peuvent, par la suite, se développer sur les œufs et nauplii présents sur le fond. L'association dans le bac d'élevage d'un détritivore comme le copépode harpacticoïde Tigriopus brevicornis permet de limiter la prolifération de bactéries. De même, associé à Brachionus sp., ce copépode nettoie le bac des détritus (Devauchelle B et al, 1974). En l'absence de prélèvement et de changement d'eau, on assiste à un déclin de la population. La diminution de la qualité des conditions du milieu entraîne une mortalité et, avec elle, une diminution de la reproduction.
Pour aller plus loin
Certains poissons que nous abritons ne mangent que des proies vivantes et leur maintien exige la présence de microfaune telle que les copépodes. Le premier exemple est le poisson mandarin : Synchiropus. Toutefois, d'autres espèces de poissons ont également besoin de cette microfaune afin d'avoir un complément alimentaire varié : Pseudochromis, labres, centropyges, blennies…un nombre important de ces poissons peut rapidement décimer la microfaune d'un bac. Ainsi, varier et adapter la population piscicole est indispensable, au risque sinon de voir la microfaune diminuer fortement. Une certaine charge en pierres vivantes reste indispensable dans le milieu même si un refuge est présent. L'utilisation d'une culture dans ce cadre peut être intéressante en vue de varier l'alimentation.
Il est facile au cours de la vie d'un bac de prélever notamment sur la vitre de l'aquarium des « souches » de copépodes et d'en faire l'élevage par la suite. Bien sûr, l'objectif d'un refuge est de favoriser le développement de la microfaune mais on n'arrive pas à avoir des niveaux de production aussi importants que si on fait une culture spécifique.
Concernant l'élevage des copépodes, l'utilisation d'aquariums est plus facile que les bouteilles. En effet, moins productifs que les rotifères, il faut compenser par un volume plus important et c'est pour cela que nous utilisons un aquarium d'environ 150 litres. Mais des volumes plus petits peuvent également être utilisés. Il n'y a pas de chauffage dans cet élevage, juste un bullage important aux extrémités (Falchier M., 1982). La salinité est la même que celle des algues afin de limiter les chocs osmotiques. Au niveau de l'éclairage, seule la lumière naturelle est utilisée.
L'objectif est de garder le plus possible une couleur verte de l'eau d'élevage, il faut donc alimenter en phytoplancton le bac d'élevage en fonction de la population en copépodes. Un dépôt se forme au fond du bac d'élevage, qui correspond aux débris de végétaux, d'excréments et de cadavres de copépodes. De nombreux copépodes se trouvent sur ces débris et notamment des copépodites. Chaque jour, lorsqu'on filtre les copépodes, on remplace le volume filtré par du phytoplancton. La filtration s'effectue au travers de filtres de différents diamètres suivant le type d'alevin que l'on désire nourrir. Les changements d'eau sont bénéfiques et, dans ce cas, on utilise l'eau issue du bac récifal. Après avoir siphonné les déchets dans des seaux, on laisse sédimenter la culture quelques heures pour récupérer les copépodes.
Les copépodes utilisés dans notre élevage sont des harpacticoïdes : Tigriopus brevicornis. Ce dernier est très peu sensible aux variations abiotiques du milieu (température, salinité) et s'adapte facilement à toutes sortes de nourriture. La densité de la population reste étroitement liée à la concentration algale du milieu. De plus, l'utilisation de l'algue dans la phase exponentielle de sa multiplication favorise le développement de ces copépodes.
5.4. Les artémias

L'artémia est un crustacé primitif appartenant à la sous-classe des branchiopodes. Il existe plusieurs espèces dont la coloration varie en fonction des conditions environnementales et du régime alimentaire. Ces organismes sont filtreurs et se nourrissent de phytoplancton. L'artémia nage continuellement afin de favoriser sa respiration et la filtration alimentaire. Généralement, les artémias vivent dans les grands lacs salés très riches en sels minéraux dont la salinité est 2 à 3 fois supérieure à celle des océans.
5.4.1. Le cycle biologique
Les œufs éclosent en 24 heures à 24 °C et en 48 heures à 20 °C. La stabilité des conditions du milieu, telles que le pH et la salinité, est une des conditions pour une bonne éclosion. La lumière et une oxygénation efficace sont également nécessaires. Les nauplii venant d'éclore sont très riches en lipides (27 % du poids sec). Puis, suite à des mues successives, les artémias deviennent moins concentrés en acides gras et ont plus de protéines en fonction de la nourriture.
Il est inutile de nourrir les nauplii les 12 premières heures après l'éclosion. Elles doivent subir une première mue avant de s'alimenter. Après la première mue, on peut apporter de la nourriture mais en faible quantité. Les nauplii acceptent des aliments comme la levure, la spiruline en poudre ou des flocons secs broyés bien que la nourriture adéquate reste le phytoplancton vivant. Il faut faire attention aux excès de nourriture qui peuvent provoquer un développement bactérien et causer la mort des artémias par manque d'oxygène. Les bactéries et les protozoaires, qui se développent souvent dans ces cultures, entrent dans le régime alimentaire des artémias.
Si on souhaite poursuivre jusqu'au stade adulte, les changements d'eau partiels sont nécessaires mais les artémias n'aiment les changements brutaux des paramètres. Certaines espèces sont parthénogénétiques, d'autres non (Artemia franciscana).
5.4.2. Conditions de vie
- La température : Les œufs ont une forme de résistance et peuvent supporter une gamme de températures très importante. Le taux le plus élevé d'éclosions et la durée minimale d'incubation sont atteints autour de 26 °C.
- La salinité : une salinité inférieure à celle de l'eau de mer (de 5 à 35 %) permet le développement normal des artémias. Plus la salinité sera basse et plus le nauplius aura une valeur énergétique élevée car il luttera moins contre la pression osmotique du milieu. Le transfert dans une eau plus salée des nauplii ne pose pas de problème de développement. Par facilité, nous utilisons une salinité de 35 ce qui donne de bons résultats en terme d'éclosion et de développement.
- Le pH : le pH doit être alcalin et stable afin d'avoir une bonne éclosion. L'enzyme d'éclosion dispose d'une activité optimale à pH de 6.5 à 8. L'ajout d'hydrogénocarbonate de soude (65 mg/l) optimise l'incubation surtout lorsque le pH descend en dessous de 7.
- La teneur en oxygène : L'éclosion peut avoir lieu en présence de teneurs faibles en oxygène (1 mg/l d'oxygène). L'aération artificielle de l'eau n'est pas nécessaire dans le cas où la température, la salinité et la densité en artémias sont faibles. Mais comme on travaille avec des densités plus élevées, on utilise une aération vigoureuse, ce qui permet aux œufs d'être toujours en suspension. Il ne faut pas utiliser de diffuseurs qui génèrent des bulles très fines mais un simple tuyau de diamètre 5 mm. Les premiers stades réclament également plus d'oxygène que les adultes car les échanges gazeux ne se font que par certaines zones du corps dotées de téguments très minces. Les adultes disposent en plus d'appendices foliacés dont les téguments sont très minces et permettent les échanges gazeux.
- La lumière : Elle joue un rôle important sur l'éclosion. On observe un meilleur taux d'éclosion lorsque la solution est placée sous la lumière. Les nauplii et les adultes sont fortement attirés par la lumière ce qui facilite la capture des individus.
5.4.3. La valeur nutritive
Les artémias se développent très rapidement et le contenu nutritionnel évolue en fonction de la croissance. Les artémias adultes et les métanauplii (nauplii de derniers stades) disposent d'une bonne valeur nutritive du fait de la haute teneur en acides aminés et une teneur en acides gras faible (10%). Les premiers stades de nauplii présentent une importante concentration en acides gras (matière grasse de 12-32%). Les alevins ont besoin d'une forte teneur en acides gras, c'est pour cela qu'on n'utilisera que les premiers stades des artémias comme nourriture. Les artémias commencent à s'alimenter lorsqu'elles sont âgées de 12 heures. Elles peuvent et doivent être enrichies avec un supplément en acides gras de la même manière que les rotifères. Divers produits commerciaux ont été élaborés à cet effet.
La culture des artémias présente l'avantage de pouvoir disposer d'une grande quantité de nourriture à partir de quelques œufs (1gramme d'œufs donne 300 000 nauplius dans un ou 2 litres d'eau salée) (Persoone et al., 1980).
Les Nauplii étant relativement grosses, seuls les alevins âgés peuvent les manger. C'est une nourriture de transition entre les rotifères, les copépodes et l'inerte d'une façon générale. L'élevage de ce crustacé est aisé, sans utiliser un matériel compliqué. De plus, il est facile d'obtenir de grandes quantités de nourriture à différents stades de développement en décalant le démarrage des lots d'œufs mis en incubation. Cela permet de nourrir les poissons à différentes étapes de leur croissance.
5.4.4. La culture des artémias
Il existe de nombreux protocoles pour la culture des artémias.(Lavens, P., Sorgeloos, P., 1996). Les œufs sont vendus sous différents conditionnements, mais afin d'avoir un bon taux d'éclosion il vaut mieux rechercher des œufs sous vide ou en conserve. Après ouverture, au contact avec l'air, le taux d'éclosion diminue. Afin de conserver un taux d'éclosion élevé, on peut conserver les œufs d'artémias dans des petits flacons individuels au congélateur (- 20 °C).
Les micro-algues (phytoplancton) permettent de poursuivre la culture des artémias jusqu'au stade adulte, mais il faut une quantité d'algue concentrée, constante et importante si on veut obtenir une culture intensive. On peut utiliser également de la levure avec toutes les précautions à prendre au niveau du dosage.
Pour réaliser la culture d'artémias, nous utilisons des bouteilles de 5 litres d'eau transparente. Pour ce volume, on rajoute deux cuillères à café de cystes d'artémias. Les artémias sont généralement à température ambiante mais pour accélérer l'éclosion, les bouteilles sont placées dans un aquarium rempli d'eau et équipé d'un thermoplongeur. Durant l'éclosion, l'éclairage est apporté par une lampe de bureau de 30 W. Les artémias sont siphonnées une fois par jour durant 4 ou 5 jours. Après la culture, l'eau est vidée et remplacée par de l'eau du bac récifal. Le taux d'éclosion semble être meilleur lorsqu'on utilise de l'eau propre, mais vieillie, prélevée dans l'aquarium principal, plutôt que de l'eau de mer fraîchement préparée. Pour le prélèvement, nous laissons reposer la culture pendant une heure avec une lumière directionnelle. Les cystes non éclos coulent au fond et les cystes vides montent en surface. Le rayon lumineux permet de concentrer les nauplii que l'on peut facilement siphonner au travers d'un filtre de 125 µm par exemple. Ces nauplii, récoltées suivant leur âge et leur destination, sont, soit données directement aux alevins, soit transférées dans une nouvelle bouteille afin de les enrichir. Dans cette bouteille, il y a 1/3 d'eau des artémias et 2/3 d'algues (Nannochloropsis, Tetraselmis) en ayant pris soin de vérifier la salinité et les paramètres de l'eau verte. Différents produits d'enrichissement tels que le Selco, sont utilisés. On peut utiliser également de la spiruline en paillettes très finement broyées.
5.4.5 La décapsulation des artémias
Pourquoi vouloir décapsuler les artémias ? La décapsulation des artémias présente de nombreux avantages :
- Les nauplii sont plus riches car elles ont utilisé moins d'énergie pour éclore.
- Absence de parasites portés par les cystes (hydraires…).
- Il n'y a pas de risque de récupérer des cystes et de provoquer des occlusions chez les alevins en cas d'absorption d'œufs non éclos ou de coquilles vides.
- Le taux d'éclosion est meilleur.
- L'éclosion est parfois plus rapide.
Le principe est de détruire la coque des œufs d'artémias. Pour cela, on peut utiliser l'eau de javel (hypochlorite de sodium). Il faut arrêter son action après un temps bien déterminé car l'eau de javel a une action néfaste sur l'œuf lui-même. A cette fin, on peut utiliser un réducteur pour empêcher la réaction de se faire. Les œufs décapsulés sont viables et peuvent être stockés au réfrigérateur.
|
1 Hydratation |
Les œufs doivent être hydratés pendant une heure avec un bullage important. Je mets une cuillère à soupe de cystes pour 200 ml d'eau. |
|
2 Décapsulation |
Cette étape est réalisée avec de l'eau de javel du commerce. J'ajoute 50 ml d'eau de javel en aérant la solution pendant 7 à 10 minutes. La réaction est exothermique (dégage de la chaleur) et pour éviter que la solution ne dépasse une température qui serait létale pour les embryons, on peut rajouter de la glace. La couleur des cystes change et passe du brun au gris puis à l'orange en quelques minutes. Lorsque 90 % des cystes sont oranges, on peut arrêter l'opération. Ces derniers tombent au fond du pot. |
|
3 Neutralisation |
Pour arrêter la réaction, j'utilise du Thiosulfate de sodium à 1 % et je rince abondamment le filtre à l'eau du robinet pour faire disparaître toute trace d'eau de javel. |
|
4 Conservation |
Les cystes décapsulés qui ne sont pas utilisés tout de suite, peuvent être stockés. On peut réaliser une saumure à 300 g/l de sel. L'eau salée va tirer l'eau hors des cystes et les déshydrater. On peut conserver les cystes décapsulés au réfrigérateur pendant un mois. |
5.5. Comparaison de la taille des organismes
Afin de pouvoir évaluer les besoins lors d'un élevage, la taille réelle des micro-organismes a été indiquée dans le tableau 4 ci-dessous. Il n'est toutefois pas toujours évident, lorsque les dimensions sont petites, de bien évaluer la taille réelle des proies. Pour cela, et afin d'avoir une meilleure visibilité, nous avons imaginé la taille d'un poisson-clown lors de l'éclosion comme équivalente à une taille à 2,5 m. Cette taille sera la taille de référence qui correspond approximativement à la taille d'une smart*. A partir de là, la proportion des tailles des autres organismes a été conservée. Afin de donner une idée, des objets similaires ont été identifiés pour chacun des organismes (pour les puristes ce n'est qu'une estimation de la taille de l'objet et pas la taille exacte de l'objet en question).
On comprend pourquoi il n'est pas envisageable de nourrir au premier stade des poissons de type A. ocellaris aux nauplii d'artémias qui sont beaucoup trop grosses par rapport aux rotifères ou aux copépodites.
| Classification | Organisme | Taille réelle |
Taille imagée (si 1mm = 1m) |
Valeur nutritive | |
|---|---|---|---|---|---|
|
Picoplancton (0,2 à 2 µm) |
Bactéries (Prochlorococcus, Synechococcus) | 0,4 – 1,2 µm |
0,4 à 1,2 mm (Acarien) |
||
|
Nanoplancton (2 à 20 µm) |
Nanochloropsis sp. | 2-3 µm |
2 à 3 mm (Tête d'épingle) |
Riche en Omega 3 | |
| Dunalliela | 10 µm |
1 cm (noyau de cerise) |
|||
|
Microplancton (20 à 200 µm) |
Copépode Nauplius Harpacticoïde (Tisbe) |
55 µm |
6 cm (Balle de tennis) |
Haute valeur en protéine, bon profil en acides aminés | |
|
Protiste C : Polyhymenophora O : Hypotrichida F : Euplotidae |
Protozoaires Ciliés (Euplote) |
100 µm | 10 cm | ||
| Brachionus rotundiformis larves Type L | 80 - 120 µm | 10 cm | La valeur en acides gras dépend de la culture | ||
|
E : Arthropodes C : Crustacé O : Harpaticoïdes |
Copépodides Tigriopus japonicus |
120 µm | 12 cm | ||
| Brachionus rotundiformis Type S |
160 µm (150-220 µm) |
18 cm (Ballon de hand) |
La valeur en acides gras dépend de la culture | ||
|
Copepodes Harpacticoides Tisbe Tigriopus japonicus |
180 - 230 µm | 20 cm | |||
|
Mesoplancton (200 µm à 2 cm) |
|||||
|
E : Arthropodes C : Crustacé Copepoda O : Calanoïdes Acartiidae). |
Copépodes Nauplius Calanoïde |
220 µm |
22 cm (Ballon de foot) |
||
|
Brachionus plicatilis Type L |
280 µm (200-300 µm) |
28 cm | |||
|
Copépode Calanoide Acartia tonsa |
400-600 µm | 40 cm | |||
|
Nauplii d'artémias Eclosion après 36 h |
460 - 750 µm | 46 - 75 cm | |||
| Larves d'Amphiprion ocellaris : J0 |
2,5 mm (2-3 mm) |
2,5 m (Smart) |
|||
| Artemia salina adultes | 1 cm | 10 m | |||
Echelle : 1mm = 1 000 micromètre = 1 000 000 nanomètre.
* tout lien avec une personne existante n'est que pure spéculation.



5.6. Synthèse sur les organismes utilisés
La synthèse (Tableau 7) permet de faciliter le choix dans l'élevage des proies.
| Organismes | Élevage | Production | Alimentation | Enrichissement | Type d'alevin |
|---|---|---|---|---|---|
| Rotifères | Facile | Elevé, cycle biologique élevé | Phytoplancton, levures, produits de substitution : selco, rotirich... | Indispensable | Toutes espèces sur les premiers jours et Clowns jusqu'aux artémias |
| Copépodes harpacticoïdes et calanoïdes : nauplii/ copépodites | Moyen | Moyenne à Faible | Phytoplancton | Inutile | Très intéressant pour toutes les espèces car de petites tailles, pélagiques et riches sur le plan nutritif |
|
Copépodes harpacticoïdes adultes |
Moyen | Moyenne | Phytoplancton, broyats de paillettes | Faible | Intéressant pour les poissons benthiques : Hippocampe reidi, Synchiropus sp. et probablement Pseudochromis sp. après métamorphose |
|
Copépodes |
Difficile | Faible, cycle de vie assez rapide, densité faible | Phytoplancton, exigeant en terme de nourriture : rotifères, ciliés, cannibalisme | Faible | Toutes espèces, et certainement indispensable pour les Centropyges sp. et les poissons chirurgiens, entre autres |
|
Artémias |
Facile | Elevé | Phytoplancton, levures, produits de substitution | Indispensable sauf quelques heures après l'éclosion | Toutes espèces, mais pas en début d'élevage : à utiliser comme moyen de transition avant passage à la nourriture sèche |
6. Méthodologie de l'élevage
La technique de l'élevage aussi bien du phytoplancton que du zooplancton répond à un certains nombre de nos critères : production quotidienne régulière, entretien réduit au minimum, coût d'exploitation faible.

Le schéma ci-dessous traduit la méthodologie utilisée pour l'élevage notamment des poissons-clowns (A. ocellaris) (voir partie II). Il existe d'autres méthodes que l'on peut adapter à sa configuration propre.
Après capture des larves (ou éclosion), les alevins sont maintenus dans un bac nu avec un simple bullage. L'eau utilisée provient du bac principal. Aucune filtration n'est utilisée et on observe rapidement des montées de nitrites et d'ammoniac du fait, entre autres, de l'abondance de la nourriture proposée. Afin de maintenir des paramètres d'eau convenables, on réalise des changements d'eau quotidiens d'un tiers du volume du bac. La main d'œuvre reste à ce stade indispensable. Il est toujours possible de mettre en place des systèmes permettant de réduire le temps. On peut, lors des premiers stades, envisager de relier le bac d'élevage au bac principal afin de réduire les risques de pollution et les changements d'eau. Toutefois, cela se traduit inévitablement par un lessivage de la nourriture, à moins d'introduire une grille suffisamment fine qui ne la laisserait pas passer. Mais la maille à utiliser (< 40 µm) est très vite obstruée par les micro-organismes, pelotes fécales, détritus, cadavres... Cela engendre un entretien et une surveillance quotidienne de la grille de surverse. C'est pourquoi le choix s'est plutôt porté sur des changements réguliers de l'eau des bacs d'élevage.
La concentration de nos élevages est encore loin des limites possibles et est fortement corrélée à la quantité et à la qualité de la nourriture proposée. Le schéma ci-dessous présente la configuration que nous utilisons pour réaliser l'élevage de plusieurs espèces à la fois. On peut déjà avoir de très bons résultats pour des espèces faciles comme le clown avec quelques bouteilles de phytoplancton et de rotifères et un petit aquarium de 20 litres.

7. Et le mésocosme....
Pour aller plus loin...
Un écosystème peut être défini par la juxtaposition de différents niveaux trophiques. Ainsi, un niveau trophique regroupe tous les organismes dont le mode de nutrition est identique. Les organismes photosynthétiques se développent à partir d'éléments minéraux et de lumière, ils se définissent comme les producteurs primaires. Les consommateurs primaires se développent aux dépens de ces organismes (niveau II). Les consommateurs secondaires et les consommateurs des niveaux supérieurs se nourrissent sur les organismes du niveau trophique immédiatement inférieur.
A partir de là, un modèle théorique a été proposé : « la Théorie des interactions trophiques en cascade » (Carpenter et al, 1985). Ce modèle traduit le fait qu'une augmentation du nombre de poissons influence en cascade les niveaux trophiques inférieurs, car ces derniers exercent une pression sur le développement du zooplancton et donc indirectement sur le phytoplancton qui est alors moins consommé.
Le développement du zooplancton est limité par la prédation exercée par les alevins de poissons. Ce zooplancton n'est plus en mesure d'exercer un contrôle efficace sur le phytoplancton dont les biomasses ne sont plus régulées que par les ressources disponibles. Toutefois, il existe des limites à cette théorie dont l'une est la diversité alimentaire de certains organismes qui dépasse le cadre des niveaux trophiques (cas des copépodes). De plus, les effets ne se limitent pas à l'abondance des organismes mais ils concernent la taille, la composition spécifique et le comportement.
En effet, l'efficacité de la prédation exercée par les larves est fonction de nombreux facteurs dont la vitesse de natation et l'efficacité dans la capture. Dans nos élevages, la vitesse de nage des alevins est plus lente lors des premiers jours d'alimentation, cela se traduit certainement par un faible taux de capture. Afin de maximiser la probabilité de rencontre entre les larves et les proies il faut une concentration élevée de proies dans la colonne d'eau. De plus l'appétence, le comportement de la proie joue un rôle important. Au bout de quelques jours (2-3 jours) on note le plus souvent une différence de taille plus marquée qui traduit un premier effet de la compétition. Les tailles des proies devront être alors adaptées à la taille des alevins.
Par expérience, l'équilibre du mésocosme parait meilleur avec les alevins d'hippocampe reidi qu'avec les alevins de poissons-clowns. Cela suggère un comportement de chasse différent et cela traduit très certainement le fait que l'on utilise une proie plus adaptée au développement des hippocampes. Par la suite la difficulté de maintenir un taux élevé pendant plusieurs semaines (mois) de ces copépodes explique la difficulté d'obtenir un grand nombre d'hippocampes.
Le mésocosme constitue un écosystème clos. Dans ce système plusieurs espèces sont présentes au travers de la chaîne alimentaire. On retrouve le producteur primaire, le phytoplancton, le zooplancton, et le prédateur final, la larve de poisson.

Afin de lancer le mésocosme, il faut développer un bloom algal avec de l'engrais (un peu pour éviter toute pollution) et de la lumière. Lorsque l'algue est en pleine croissance, on peut mettre le zooplancton puis c'est au tour des alevins de poissons.
Le zooplancton (rotifères et copépodes) se développe aux dépens de l'algue mais ce dernier est consommé rapidement par les larves de poissons. De ce fait, la pression du zooplancton sur l'algue est moindre. L'algue continue à se développer grâce à la lumière et grâce aux composés nutritifs dissous dans l'eau. Les larves consomment les rotifères enrichis par l'algue présente dans le milieu de culture. L'objectif est d'obtenir une chaîne alimentaire complète, avec un approvisionnement constant en nourriture vivante suivant le besoin. Cet équilibre est cependant extrêmement précaire, il faut adapter le nombre de larves de poissons à la quantité de zooplancton. De plus, le volume du bac doit être relativement grand, cette méthode sera difficilement envisageable sur des volumes inférieurs à 400 litres.
Il faut observer chaque jour sous binoculaire le taux de croissance du zooplancton afin d'assurer une alimentation suffisante.
8. Conclusion
La mise en place d'un élevage de poissons marins amène à rechercher des proies diversifiées et facilement exploitables dans le cadre d'un élevage. Ces organismes doivent être adaptés aux exigences des premiers stades juvéniles des poissons. La taille des proies est prépondérante dans la réussite d'un élevage et il est toujours intéressant d'avoir tout un continuum de tailles au travers d'un cortège d'organismes (ou de stades de développement) afin de pallier à la demande des alevins aussi bien en terme quantitatif que qualitatif. De plus, la connaissance des besoins biologiques de chacun des organismes est indispensable afin de savoir quelle espèce peut être maintenue spécifiquement ou de façon mixte. La réussite d'un élevage demande un peu de temps mais c'est loin d'être insurmontable. L'intensité des prélèvements et la maintenance des élevages, de par la nourriture, jouent un rôle prépondérant sur le développement de ces organismes. L'une des clefs de la réussite d'un élevage de poissons marins réside dans l'obtention d'une culture de proies en constante production. L'emploi de proies vivantes, au moins pendant les premiers jours ou semaines des élevages, reste une obligation. On peut toutefois dire que les méthodes de production de proies, susceptibles de permettre la reproduction de n'importe quelle espèce marine, existent et sont applicables. On peut donc envisager une production d'espèces marines de plus en plus importante, le seul frein est le temps passé à l'entretien des cultures et à la maintenance de l'élevage.
9. Références bibliographiques
9.1. Publications
- Audineau, Blancheton , 1986. Production d'algues unicellulaires. Rapport d'activité de l'équipe MEREA de l'Ifremer Palavas les Flots, 19p.
- Carpenter S.R., Kitchell J.F., Hodgson J.R., 1985. Cascading trophic interactions and lake productivity. Fish predation and herbivory can regulate lake ecosystem. Bio Science 35 : p 634-638.
- Devauchelle B., Girin M.,1974. Production du rotifère « Brachionus plicatilis O. F. Muller » en élevage mixte avec le copépode « Tisbe furcata » (Baird), Colloq. Aquacult., p 87 à 99.
- Falchier M., Lassus P., Bardouil M., Le Dean L., Truquet P., Bocquene G., 1982. Sensibilité thermique d'un copépode harpacticoïde : Tigriopus brevicornis Muller, 12p.
- Hoff F.H., Snell T. W., 1987. Plankton culture manual, First edition, Florida Aqua Farms, Inc., 126p.
- Jonsson R., Tiselius P., 1990. Feeding behaviour, prey detection and capture efficiency of the copepod Acartia tonsa feeding on planktonic ciliates. Marine Ecology, Vol. 60, p35-44.
- Kanazawa, A., Teshima S. I., Ono K., 1979. Relationship between essential fatty acid requirements of aquatic animals and the capacity for bioconversion of linolenic acid to highly unsaturated fatty acids. Comp. Biochem. Physiol., 63 B, p 295–298.
- Klein Breteler W. C.M., 1980, Continuous Breeding of Marine Pelagic Copepods in the presence ofheterotrophic dinoflagellates, Marine Ecology Vol.2, p 229-233.
- Lavens, P; Sorgeloos, P., 1996, Manual on the production and use of live food for aquaculture, FAO Fisheries Technical Paper. No. 361. Rome, 295p.
- Lee C.S., O'Bryen P., Marcus N.H., 2005. Copepods in Aquaculture. Blackwell Publishing, New York.
- Mauchline, J., 1998. The Biology of Calanoid Copepods Advances in Marine Biology, Vol. 33. p 710.
- Pearson-Le Ruyet, 1975, Elevage de copepods Calanoïdes Biologie et dynamique des populations premier résultats Ann. Inst. Océanogr., Paris, 51 (2), p 203-221.
- Persoone, G., Sorgeloos, P., Roels, O. & Jaspers, E. 1980. The brine shrimp Artemia. Proceedings of the International Symposium on the brine shrimp Artemia salina. Corpus Christi, Texas, USA, p 404.
- Pourriot R., 1980. Intérêt des rotifères en aquaculture marine, Océania, Vol 9, Fasc 3. p 419 – 431.
- Razouls C., de Bovée F., Kouwenberg J. et Desreumaux N., 2005-2011. - Diversité et répartition géographique chez les Copépodes planctoniques marins.
- Sazhina, L.I., 1987. Reproduction, Growth, Production of Marine Copepods. Naukova Dumka, Kiev. pp 156.
- Seychelles, L. H., Audet C., Tremblay R., Fournier R., Pernet F., The preservation and transfert of essential fatty acids in frozen-concentrated microalgae to cultured rotifers (Brachionus plicatilis, Müller) sous presse.
9.2. Sites Internet
- Frank Marini, Ph.D., Dwayne Sapp, Advanced Aquarists - The Breeder's Net: A Simple How-to On Home Culture Of Copepods.
- Crustacea.net
- Forum Mysis
Olivier SOULAT
Article publié par Cap Récifal le 07 octobre 2011 avec l'aimable autorisation de l'auteur.


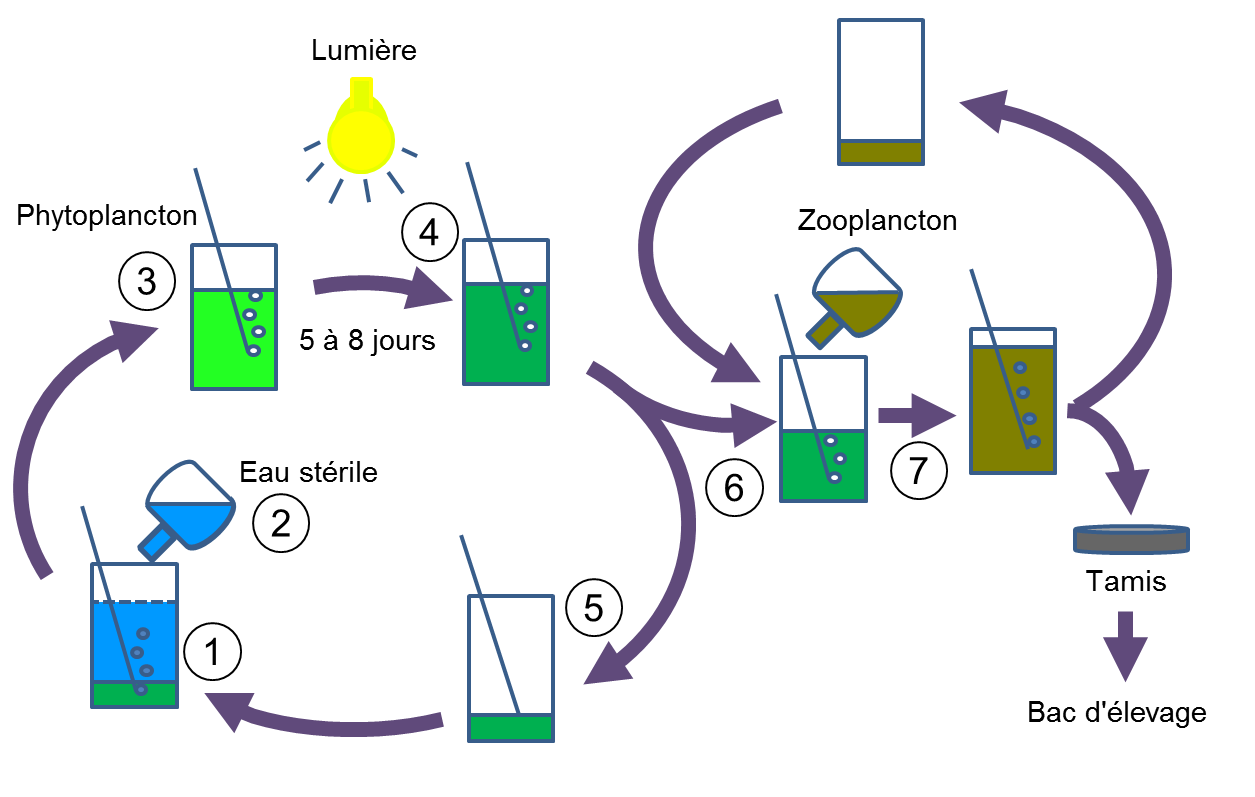
Commentaires recommandés
Il n’y a aucun commentaire à afficher.
Join the conversation
You can post now and register later. If you have an account, sign in now to post with your account.